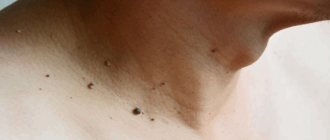
Вирус папилломы человека — одна из самых распространенных, наряду с герпесом, хронических инфекций. Поэтому анализ на ВПЧ очень востребован при диагностике многих заболеваний. Анализы на все виды папилломавируса человека проводятся у нас в клинике ежедневно.
Основные виды папиллом человека:
- Кожные папилломы: Обычные нитевидные, на тонкой ножке. Располагаются чаще всего в подмышечных областях, на шее, веках глаз, в области молочных желез и паху
- Плоские папилломы — цвета окружающей кожи, немного возвышаются над ней. В основном находятся на пальцах конечностей, кистях рук.
- Бородавки — папилломатозные образования с ороговением на поверхности. Могут быть везде, но чаще на конечностях. Особенно приносят проблемы при их расположении на подошвах стоп и вокруг ногтей.
Все эти виды папиллом развиваются при наличии различных типов вируса папилломы человека, выявляемых при помощи специальной лабораторной диагностики, о которой и пойдет речь.
Причины возникновения заболевания
Вирус — это инфекция, а значит для его появления в организме должно произойти заражение.
ВПЧ проникает в кожу и слизистые оболочки здорового человека при их контакте с папилломами больного или с визуально неизмененными кожными покровами и слизистыми инфицированного человека при условии, что в месте контакта находится большое количество вируса и имеются повреждения целостности эпителия (потертости, царапины, ранки, эрозии, язвочки). Особенно характерно заражение ВПЧ при наличии высыпаний простого герпеса, через которые в кожу и кровь проникает вирус папилломы человека.
Какие анализы сдавать на ВПЧ?
У нас в клинике проводятся следующие анализы на вирус папилломы человека:
- Анализ ПЦР на 6 и 11 типы ВПЧ — берется соскоб с высыпаний или интересующих врача слизистых оболочек. Материал помещается в пробирку и исследуется в течение 1–2 дней. В зависимости от варианта выполнения анализа ответ может быть:
- Положительный — при обнаружении вируса с указанием конкретного типа
- Если использовался количественный метод, то указывается сколько вирусных частиц обнаружено
Отрицательный — при отсутствии ВПЧ в исследуемом материале
Вирусы ВПЧ 6 и 11 типов относятся к группе низкого онкогенного (канцерогенного) риска и, в основном, вызывают только рост генитальных бородавок или остроконечных кондилом, редко перерождающихся в рак.
Цена анализа на ВПЧ 6 и 11 типов от 300 руб. за качественный анализ.
Результатом диагностики может быть как обнаружение определенного типа вируса, так и его количество.
Вирусы папилломы человека 16 и 18 типов относятся к самым злокачественным в плане онкогенного риска и чаще остальных приводят к развитию раки шейки матки, кожи и слизистых оболочек. Поэтому их и выделяют в отдельную диагностическую группу.
Стоимость анализа на ВПЧ 16 и 18 типа от 300 руб. за качественный вариант диагностики, 800 руб за количественный.
Срок выполнения анализа от 1 суток.
- Качественный без определения типа — анализ просто покажет есть ли в соскобе клеток вирусы этих типов без детализации
Качественный с определением типа (с генотипированием) — результат будет содержать указание на наличие конкретного типа ВПЧ
Стоимость анализа от 900 руб. за качественный вариант.
Как определить вирус ВПЧ
Для того, чтобы не допустить фатального развития событий, необходимо время от времени обследоваться на ВПЧ.
Если же выявлены подозрительные очаги, неважно, где – на шейке матки у женщин или на головке пениса у мужчин, необходимо идентифицировать тип возбудителя (их может быть и несколько) и определить количество вирионов.
Количественный анализ ВПЧ также помогает составить прогноз по малигнизации (перерождению образования в рак) – чем больше копий онкогенного типа ВПЧ в образце, тем риск выше.
В современной дерматовенерологии может рекомендоваться сдать несколько видов анализов и тестов:
- Цитология. Это микроскопия клеток из подозрительного очага, может находить признаки рака. Не подходит для идентификации типа вирусов или ранней диагностики на стадии предраковых явлений.
- Кольпоскопия с обработкой очага уксусной кислотой, раствором Люголя. Позволяет точно установить границы поражения.
- Анализ ПЦР на ВПЧ. Прекрасный молекулярно-генетический метод, который мы рассмотрим немного ниже.
- Серологические тесты. Для клинической практики малоинформативны, их чаще используют для проведения эпидемиологических исследований по ВПЧ.
Во всем цивилизованном мире, ключевая роль в диагностике папилломавирусной инфекции отводится молекулярно-генетическим методам – ПЦР, Digene (дайджин) тест.
Когда осуществялется забор материала?
Методика забора материала для диагностики и вообще сам материал зависят от проявлений папилломавирусной инфекции.
Если имеются элементы на коже и видимой слизистой оболочке, то при помощи универсального урогенитального зонда врач дерматовенеролог или гинеколог проводит соскоб клеток с поверхности папилломы. Полученные клетки помещаются в пробирку для доставки в лабораторию и проведения анализа ПЦР на ВПЧ. Манипуляция абсолютно безболезненная и занимает около 30 секунд.
При диагностировании папилломавирусной инфекции в уретре, во влагалище, цервикальном канале, особенно при наличии эрозии шейки матки, соскоб проводится из этих органов, желательно и самой эрозии.
Если папилломы имеются на слизистой ротовой полости или прямой кишки, то зондом берут материал с этих участков.
При необходимости диагностики заболеваний предстательной железы, мочевого пузыря может на ВПЧ браться моча и секрет простаты.
Как сдается анализ на ВПЧ при соскобе?
Данная диагностика мало зависит от предшествующей подготовки. Хотя будет неплохо, если Вы исключите воздействие антисептиков на кожу и слизистые оболочки, с которых врач будет брать соскоб клеток.
На приеме у дерматовенеролога, венеролога, уролога или гинеколога производится забор эпителиальных клеток при помощи специального зонда с интересующей области:
- Уретра
- Головка полового члена, особенно высыпания, эрозии, язвы на ней
- Кожа полового члена с высыпаниями
- Кожа анальной области, слизистая прямой кишки
- Большие и малые половые губы
- Слизистая оболочка влагалища
- Канал шейки матки
- Влагалищная часть шейки матки
- Слизистая щеки, языка, губ, десен
- Слизистая оболочка ротоглотки, носоглотки, гортани.
Все манипуляции абсолютно безболезненны и малотравматичны.
Только доктор производит забор материала! В наших клиниках мы даже среднему медицинскому персоналу не доверяем данную процедуру, потому что для качественного исполнения анализа сам соскоб даже более важен, чем дальнейшее исследование.
При обследовании на вирусы папилломы человека нужно учитывать кроме всего прочего следующие моменты:
- ВПЧ вызывает не только рост папиллом, кондилом, развитие эрозий и рака шейки матки. С ним связана масса других заболеваний и клинических проявлений на коже и слизистых оболочках.
- Поэтому стоит прислушаться к врачу венерологу, урологу или гинекологу, который при определенной клинической картине у пациента назначает анализы на ВПЧ того или иного типа, либо комплексный анализ на ВПЧ (вирус папилломы человека).
- У одного и того же человека могут находиться несколько типов ВПЧ, причем не обязательно все эти типы проявят себя одновременно клинически и определятся в анализе.
- Поэтому после лечение необходимо сдавать развернутый анализ на ВПЧ, а не ограничиваться одним типом, который был определен при первичной диагностике.
- Половые партнеры пациентов, инфицированных вирусом папилломы человека, сдают также анализы на все виды ВПЧ.
Какие виды анализов на ВПЧ нужно сдавать, определит только врач. Это зависит от клинических проявлений инфекции, типа папиллом, расположения элементов и результатов обследования партнера, если таковые имеются.
| (20.6 Кб в архиве, формат MS Word) | «Лабораторная диагностика» №1(9) 2013 г. |
| ПРИ ПУБЛИКАЦИИ МАТЕРИАЛОВ ССЫЛКА НА ИСТОЧНИК ОБЯЗАТЕЛЬНА !!! | |
| ПОДПИСКА НА ЖУРНАЛ | |
Иммуноферментный анализ в комплексной диагностике герпесвирусных инфекций
Т.И. Долгих – заведующая Центральной научно-исследовательской лабораторией, руководитель
Академического центра лабораторной диагностики ОмГМА, доктор медицинских наук, профессор.
Государственное бюджетное образовательное учреждение высшего профессионального образования
“Омская государственная медицинская академия” Министерства здравоохранения Российской Федерации
На фоне роста иммунодефицитов, аллергических и аутоиммунных заболеваний наблюдается герпесвирусных инфекций, способных формировать тяжелую патологию различных органов и систем, приводить к инвалидизации и быть причиной летального исхода. Среди данной группы инфекций наиболее значимыми являются герпетическая (ВПГ-инфекция) и цитомегаловирусная инфекции (ЦМВ-инфекция), а также инфекция, вызываемая вирусом Эпштейна-Барр (ВЭБ-инфекция). Учитывая широкую распространенность этих возбудителей и сходную клиническую картину, актуальным становится вопрос об оптимальном алгоритме диагностики.
Для выбора тактики ведения пациента принципиально важно установить фазу инфекционного процесса и оценить адекватность иммунного ответа макроорганизма на воздействие патогенов. Тактика врачей по выявлению оппортунистических инфекций зачастую отличается односторонним подходом и нередко базируется на определении cпецифических антител классов IgG и IgM (в отдельных лабораториях дается лишь качественная оценка суммарных антител), что нередко “загоняет” врача в “серологический тупик” и приводит к гипо- или гипердиагностике.
Несмотря на относительно высокую стоимость анализов, использование комплекса лабораторных тестов вполне оправданно, так как этиологическая расшифровка диагноза принципиально влияет на тактику ведения пациента, определяет необходимость этиотропной и иммуномодулирующей терапии, а в отдельных случаях позволяет прогнозировать исход. Рациональное использование тест-систем на основе предложенных принципов на отдельных этапах обследования пациента позволяет избежать ненужных многократных исследований.
Наряду с полимеразной цепной реакцией (ПЦР), направленной на детекцию генетичес-
кого материала потенциального возбудителя, по-прежнему повсеместно используют иммуноферментный анализ (ИФА). Он направлен на выявление антител различных классов (IgМ, IgА, Ig) в сыворотке крови, плазме, спинномозговой жидкости. Определение суммарных антител при диагностике герпесвирусных инфекций имеет низкую диагностическую ценность, дает лишь предварительную информацию о наличии инфекции и требует дальнейшего лабораторного уточнения.
Для подтверждения диагноза и мониторинга все чаще используют иммуноблот (Western-blot, Line-blot), направленный на выявление антител к отдельным антигенам возбудителей герпес-вирусных и других инфекций.
Классы иммуноглобулинов
IgM – наиболее “ранние” антитела, поскольку образуются на ранних стадиях инфекционного процесса. Они способны агглютинировать бактерии, нейтрализовывать вирусы, активировать комплемент и играют важную роль в элиминации возбудителя из кровеносного русла. Не проникают через плаценту, синтезируются еще у плода и относятся к собственным антителам новорожденных. Их наличие указывает на заражение
(в том числе и внутриутробное), свидетельствует об активном процессе. Уровень IgM-антител может повышаться при реактивации, реинфицировании или суперинфицировании.
IgG – играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях, вызывая гибель возбудителя с участием комплемента и опсонизируя фагоцитарные клетки. Наибольшее значение в противоинфекционной защите имеет субкласс IgG2. IgG проникают через плаценту и формируют антиинфекционный иммунитет у новорожденных.
В последние годы появилась возможность определения так называемых “ранних” специфических IgG, которые обладают низкой авидностью и указывают на первичную инфекцию (данный тест используется при диагностике ЦМВ-инфекции, ВПГ-инфекции). Высокоавидные антитела являются показателем давнего инфицирования и ранее перенесенной инфекции. Авидность антител в сыворотках оценивают по индексу авидности (ИА), который выражают в %. Выявление ДНК или антигенов (“ранних белков”) возбудителя на фоне высокоавидных антител указывает на персистирующую инфекцию и свидетельствует в пользу активности инфекционного процесса.
IgA – существует в двух формах: секреторной и сывороточной. Он не проходит через плаценту. Секреторный IgA содержится в молоке, молозиве, слюне, в слезном, бронхиальном и желудочно-кишечном секрете, желчи, моче. Это основной вид иммуноглобулинов, участвующих в местном иммунитете. Синтез сывороточных IgA начинается с конца первого месяца заболевания
и продолжается до тех пор, пока антиген доступен иммунокомпетентным клеткам. Его обнаружение свидетельствует об остром или подостром процессе, реактивации и суперинфекции. Тест показателен при диагностике врожденных форм инфекций, поскольку IgA не проходят через плаценту, а нарабатываются в организме ребенка в ответ на воздействие инфекционного агента. Целесообразно его использование для определения активности инфекционного процесса при ЦМВ-, ВПГ-и ВЭБ-инфекции.
Причины ложно-положительных результатов ИФА
Как и при других реакциях, при ИФА возможен ложно-положительный результат. Причины ложно-положительных реакций следует разделить на следующие группы:
— ошибки на преаналитическом этапе, связанные с нарушением правил взятия биоматериала (рекомендуется проводить забор крови в пластиковые пробирки, предназначенные для сыворотки, лучше со свертывателем крови), гемолиз, бактериальное обсеменение крови или сыворотки (имеет место в случае нарушения температурного режима при хранении или транспортировки) пробирок с биоматериалом;
— ошибки на аналитическом этапе при нарушении технологического процесса, а также зависящие от качества тест-систем и квалификации персонала;
— ошибки на постаналитическом этапе (зависят от ответственности и квалификации персонала).
Особо следует выделить причины ложно-положительных результатов, не зависящие от сотрудников лаборатории. Наиболее часто неправильный встречается при определении специфических антител класса IgМ и может быть обусловлен наличием ревматоидного фактора, гиперпродукцией IgM при беременности, перекрестной реакцией с антигенами других возбудителей, аутоиммунным процессом, нарушением обмена веществ, липидемией и др. В данном случае использование ряда лабораторных приемов позволяют получить достоверный результат анализа. К ним в первую очередь следует отнести: удаление ревматоидного фактора из сыворотки, использование на первом этапе постановки или в качестве подтверждающих тестов высокоспецифичных тест-систем зарубежного производства, повторное исследование сыворотки, применение в качестве подтверждающего теста иммуноблота-IgM (или лайн-блота), направленного на выявление антител именно класса IgM к отдельным антигенам возбудителя. Наряду с этим, следует помнить, что IgM являются показателем острого и активного инфекционного процесса. Обнаружение ДНК возбудителя или его антигенов прямыми методами или появление антител других классов в результате переключение синтеза антител в динамике позволяют верифицировать диагноз.
При детекции IgG-антител может быть получен ложно-положительный результат, связанный прежде всего с перекрестным реагированием антигенов (например, между ЦМВ и ВПГ) и напрямую зависящий от специфичности тест-систем. Для уточнения лабораторного диагноза и исключения ложнопозитивного результата следует применять иммуноблот (Westernblot-IgG, Line-blot), предназначенный для обнаружения IgG к отдельным высокоспецифичным белкам патогена. Line-blot отличается тем, что на нитроцеллюлозную мембрану нанесены или ими усилены специфические белки, обладающие высокой диагностической информативностью.
Метод иммуноблота (Westernblot, Line-blot, recom-Line) – новое поколение референтных методов, высокоспецифичных и высокочувствительных, подтверждающих (или исключающих) диагноз при подозрении на инфекции в случае получения положительных или сомнительных (неопределенных) результатов при исследовании сыворотки крови или ликвора в ИФА. Позволяет определять антитела к отдельным антигенам возбудителя. Представляет собой индивидуальный оценочный шаблон (нитроцеллюлозную мембрану) с нанесенными раздельными белками (антигенами). Имеет возможность автоматизации исследования. Для оценки сигнала принимают во внимание положение и интенсивность окрашивания полос.
При ЦМВ-, ВПГ- и ВЭБ-инфекциях для установления активности инфекционного процесса следует: 1) принимать во внимание особенности формирования иммунного ответа пациентов различных возрастных групп; 2) учитывать диагностически значимую динамику (нарастание показателей на 2-3 порядка), если это позволяет временной фактор и не требуется оперативной диагностики (!); 3) использовать комплекс лабораторных тестов в зависимости от цели и задачи исследования, включая (особенно в случае необходимости быстрой диагностики выявление антител класса IgА, низкоавидных IgG (при первичном выявлении) и IgG в спинномозговой жидкости (при поражении ЦНС); 4) исключить сочетанное инфицирование герпесвирусами; 4) у беременных определить наличие факторов риска инфицирования плода.
Особенности лабораторной диагностики внутриутробной инфекции (ВУИ)
При подозрении у ребенка ВУИ чаще всего проводят исследования на наличие маркеров герпесвирусных инфекций. Обследование матери во время беременности в большинстве случаев позволяет исключить те инфекции, на которые получены отрицательные результаты, и вести прицельное обследование ребенка. Однако надо помнить о возможности заражения женщины в поздние сроки беременности, что в условиях хронической фетоплацентарной недостаточности и вторичного иммунодефицита (в том числе ВИЧ-инфекции) приводит к заражениию плода или новорожденного.
Если мать не была ранее обследована, то для оперативной и более достоверной диагностики ВУИ рекомендуется проводить параллельное исследование крови матери и ребенка. При этом возможны разные ситуации, вызывающие у врачей затруднения по интерпретации результатов.
Именно в диагностике неонатальной патологии наибольшее диагностическое значение имеют дополнительные тесты (определение низкоавидных антител, IgA, антигенов и (или) ДНК возбудителя). Выявление только IgG является малоинформативным ввиду циркуляции материнских антител, полученных ребенком трансплацентарно (“иммунный вклад беременной женщины”). Рекомендуется определение IgМ, IgA, ДНК или антигенов возбудителя, оценка клинических данных, сопоставление результатов общеклинического и функционального обследования.
Следует помнить, что при обследовании новорожденных на ВУИ может быть получен ложноотрицательный результат серологического исследования в результате влияния высокой концентрации материнских антител класса IgG (маскируют наличие IgM у ребенка) или иммунологической толерантности, поэтому предпочтительно использовать прямые методы диагностики, направленные на обнаружение антигенов возбудителя (РИФ) и его нуклеиновой кислоты (ПЦР) в крови или спинномозговой жидкости (при условии проведения спинальной пункции по медицинским показаниям). Под иммунологической толерантностью понимают неспособность организма к иммунному ответу на определенный антиген. Сроки ее формирования варьируют от нескольких часов до нескольких суток; длительность зависит от персистенции антигена в организме и скорости образования иммунокомпетентных клеток из их предшественников; индукции толерантности способствует неспецифическая иммунодепрессия (в том числе под влиянием лекарственных препаратов). Толерантность может возникнуть при антигенной перегрузке; она не носит постоянного характера, ее продолжительность может увеличиваться периодическим попаданием антигена. Выход из состояния толерантности может быть спонтанным или индуцированным.
Обнаружение специфических антител класса IgM и/или IgА у детей раннего возраста однозначно указывает на инфицированность ребенка (через плаценту IgM и IgА не передаются и являются собственными антителами, нарабатываемыми в присутствии антигенов возбудителя). Полученные нами данные свидетельствуют о сложности диагностики врожденной формы оппортунистических инфекций и редком обнаружении IgM у новорожденных и детей раннего возраста. При преобладании неврологической симптоматики уровень специфических антител IgG в сыворотке крови может не определяться или быть невысоким.
В данном случае наибольшее диагностическое значение имеет исследование спинномозговой жидкости на наличие специфических антител или антигенов возбудителя.
Причинами ложноотрицательного серологического исследования могут быть: 1) иммунологическая толерантность (чаще); 2) влияние высокой концентрации материнских антител класса IgG (маскируют наличие IgM и собственных IgG у ребенка), причем у серонегативных детей с врожденной инфекцией IgM, IgА и IgG могут появиться в более позднем возрасте (на 6-8 мес. жизни); 3) усиленная антигенная стимуляция иммунной системы, что имеет место при сочетанном инфицировании, особенно в случае активной вирусной инфекции (цитомегаловирусной или герпетической).
Наиболее тяжелые последствия для плода и новорожденного возникают при сочетанном инфицировании токсоплазмами и ЦМВ или ВПГ, причем такие сочетания нередки (возможно обнаружение у мертворожденного обоих внутриклеточных организмов в альвеолярных и интраальвеолярных макрофагах: включения токсоплазм обнаруживались в цитоплазме, а ЦМВ – в ядрах).
Лабораторная диагностика поражения цнс при ЦМВ-, ВПГ и ВЭБ-инфекции
Поражение мозга в виде менингита, мениго-энцефалита или энцефалита, вызванное герпес-вирусами, происходит у лиц с иммунодефицитами. Высокий риск заболевания отмечен у ВИЧ-инфицированных пациентов.
У новорожденных детей и детей раннего возраста наряду с выраженной патологией со стороны мозга может наблюдаться микро- или гидроцефалия, при нейросонографии выявляться признаки гидроцефального синдрома.
Для верификации диагноза и адекватной терапии исследование спинномозговой жидкости с целью этиологической расшифровки имеет принципиальное значение. При поражении мозга рекомендуется использовать специальные тест-системы (производства фирмы “EUROIMMUN”, Германия), предназначенные для выявления методом ИФА специфических антител в спинномозговой жидкости (с параллельным исследованием сыворотки крови).Они содержат дополнительные калибраторы для спинномозговой жидкости и позволяют дифференцировать антитела, продуцируемые интратекально, от антител, проникших из крови в спинномозговую жидкость через гематоэнцефалический барьер в результате повышения его проницаемости. Обязательно параллельное исследование сыворотки крови. Определяется соотношение IgG в ликворе и сыворотке крови и концентрация в обеих биологических жидкостях альбумина. Известно, что в случае поражения ЦНС токсоплазмами или вирусами в ликворе накапливаются специфические антитела в большом количестве. При локальном поражении мозга их уровень в ликворе значительно превышает содержание антител в сыворотке крови. Рассчитав индекс LSQ относит., можно подтвердить (или исключить) поражение мозга токсоплазмами или вирусами. Индекс более 1,5 указывает на интратекальную продукцию антител к данному возбудителю. При прогрессирующем поражении мозга этот коэффициент будет возрастать, что имеет важное диагностическое и прогностическое значение.
Ввиду продукции антител в ЦНС при различных патологических состояниях (при множественной миеломе или при рассеянном склерозе) для уточнения интратекальной продукции специфических IgG пользуются диаграммой Рейбера
(1991 г.) с определением индекса СSQ, при расчете которого учитывается концентрация альбумина, который нарабатываются только в печени, но не интратекально.
Поскольку в случае микст-инфекции при повреждении гемато-энцефалического барьера в спинномозговой жидкости могут оказаться антитела разных патогенов, то использование данных тестов позволит определить ведущего агента, ответственного за прогрессирующее поражение мозга.
Интерпретация результатов исследований на цитомегаловирусную инфекцию
Специфические антитела отвечают за лизис внутриклеточного вируса, а также ингибируют его внутриклеточную репликацию или распространение от клетки к клетке. Сыворотки пациентов после первичной инфекции содержат антитела, реагирующие с внутренними протеинами ЦМВ (р28, р65, р72). К высокоспецифичным белкам относится р130. В сыворотке выздоровевших содержатся в основном антитела, реагирующие с гликопротеинами оболочки.
Наибольшее диагностическое значение имеет детекция IgM, как показателя активности процесса, что может свидетельствовать об остром заболевании, реинфекции, суперинфекции или реактивации. Выявление IgG у ранее серонегативных лиц также позволяет определить первичную ЦМВ-инфекцию, проводить наблюдение в динамике за лицами с клиническими проявлениями инфекции и оказывает существенную помощь при ретроспективной диагностике. Следует помнить, что у многих пациентов с выраженным иммунодефицитом (в том числе при сПИДе) и тяжелой ЦМВ-инфекции, а также у беременных и детей раннего возраста выработка антител к ЦМВ замедлена. Это проявляется обнаружением специфических антител в низкой концентрации или отсутствием положительной динамики антител. В данном случае решающее значение имеет детекция IgА, “ранних” IgG-антител (низкоавидных антител) и/или “ранних” антигенов или ДНК ЦМВ. Показатель авидности менее 40% указывает на наличие первичной ЦМВ-инфекции.
После лечения этиотропными и иммуномодулирующими препаратами при контрольных анализах, как правило, отмечается значительный подъем уровня антител IgG, при этом ИА может снижаться, что следует оценивать как положительный фактор и не спешить с назначением повторного курса. Настораживает появление в последнее время случаев с отрицательными результатами контрольных исследований на ЦМВ-инфекции на фоне персистенции ЦМВ. Это может свидетельствовать о негативной активации В-лимфоцитов после применения химических иммуномодуляторов.
Иммуноблот (Westernblot) – уникальный тест, который позволяет раздельно детектировать IgM и IgG к отдельным белкам ЦМВ, следить в динамике за сменой белков, что имеет высокое диагностическое и прогностическое значение. Антигены ЦМВ подразделяют на три категории:
1) перекрестно-реагирующий антиген с молекулярной массой 65 кДа и неопределенные антигены;
2) низко специфичный антиген с молекулярными массами 55 кДа, 52 кДа и 38 кДа;
3) высоко специфичные антигены с молекулярными массами 130 кДа и 28 кДа.
Наличие высокоспецифичных антигенов подтверждает формирование иммунного ответа к ЦМВ, а наличие хотя бы одной полосы категории 3 (pp 130 и p28) свидетельствует о положительном результате. Присутствие рр65 (предранний белок) расценивается как маркер первичной (острой) инфекции или реактивации. Не исключена его наработка при суперинфекции. По мере развития инфекционного процесса появляется p28.
Опыт работы свидетельствует о возможности использования иммуноблота как при диагностике врожденной ЦМВ-инфекции, так и приобретенной формы, в том числе у лиц с выраженным иммунодефицитом (при ограничении синтеза антител или при их поликлональной наработке).
Использование данного теста при обследовании детей, родившихся с признаками внутри-утробной инфекцией или от матерей, у которых в период беременности были клинические и/или лабораторные признаки активной инфекции, позволяет установить (исключить) внутриутробную (перинатальную) инфекцию. Если в период новорожденности РИФ (ПЦР) дают отрицательные результаты при исследовании крови, а выявление IgG (материнские антитела) не позволяет выставить ЦМВ-инфекцию, то рекомендуется провести повторное обследование через 1,5-2 месяца. В случае инфицирования появляются антитела класса IgM к “ранним” белкам (р65, р28) и/или IgG к ним, что нередко коррелирует с позитивными результатами РИФ и/или ПЦР и нарастанием клинических симптомов (прежде всего со стороны ЦНС).
Интерпретация результатов исследований на герпетическую инфекцию
Выявление ДНК или ранних белков ВПГ-1 и ВПГ-2 в лейкоцитах крови свидетельствует о репликации вируса. ИФА используется для определения антител классов IgM, IgG, IgА и авидности IgG к ВПГ. Наибольшее диагностическое значение имеет детекция IgM, как показателя активности процесса, что может свидетельствовать об остром заболевании, реинфекции, суперинфекции или реактивации. Однако в клинически выраженных случаях, в том числе при типичном течении неонатального герпеса, специфические IgM выявляются редко. У многих пациентов с выраженным иммунодефицитом и тяжелой герпетической инфекцией (генитальный герпес), а также у беременных и детей раннего возраста выработка антител к ВПГ замедлена. Это проявляется ограниченным синтезом специфических антител (они обнаруживаются в низкой концентрации) или отсутствием положительной динамики антител. В данном случае решающее значение в диагностическом плане имеет выявление ВПГ-IgА и/или “ранних” антигенов ВПГ. Следует отметить, что индекс авидности менее 40% указывает на наличие первичной герпетической инфекции, однако такие случаи выявляются редко и встречаются преимущественно у детей. В дальнейшем на фоне рецидивов чаще всего ИА остается на высоких цифрах, в связи с чем данный тест имеет более низкую диагностическую и прогностическую информацию, чем при ЦМВ-инфекции.
Имеющийся опыт работы с тест-системами, направленными на выявление IgА к ВПГ-1 и 2, показал целесообразность его использования не только с целью диагностики, но и с целью прогнозирования течения заболевания, оценки эффективности противовирусной терапии и мониторинга. Особо важное значение тест имеет для диагностики врожденной формы герпетической инфекции, поскольку IgА относится к тем иммуноглобулинам, которые не проходят через плаценту, и его обнаружение свидетельствует о заражении. Появление IgА к ВПГ в сыворотке крови в большом количестве при наличии (или отсутствии) клинических проявлений косвенно указывает на активацию вируса и обосновывает даже при отсутствии клинических проявлений проведение иммунореабилитационных мероприятий (метод “упреждающей терапии”).
Иммуноблот (Westernblot, Line-blot) – позволяет дифференцировать в одном тесте белки, характерные для активации ВПГ 1 и 2 типов, раздельно детектировать IgM и IgG к отдельным белкам, следить в динамике за их сменой, что имеет высокое диагностическое и прогностическое значение. Источником антигенов является полный комплекс антигенов ВПГ-1 типа и гликопротеин G-2 ВПГ-2 типа, очищенный аффинной хроматографией. На нитроцеллюлозную мембрану стрипов методом прерывистого электрофореза перенесены отдельные вирусные белки предварительно культивируемого ВПГ-1, затем стрипы покрываются мембранным чипом, содержащим очищенный гликопротеин G-2 ВПГ-2.
Специфичность антигенов на стрипе
| Полоса на стрипе | Антиген | Описание | Категория |
| 130 кДа | pp 130 | Фосфопротеиновый антиген: UL57 | 3 |
| 65 кДа | pp 65 | Тегументный фосфопротеиновый антиген (протеин оболочки): UL83 | 1 |
| 55 кДа | p 55 | Гликопротеин В антиген gB: UL55 | 2 |
| 52 кДа | pp 52 | Фосфопротеиновый антиген: UL44 | 2 |
| 38 кДа | p 38 | 2 | |
| 28 кДа | p 28 | Капсидный протеиновый антиген: UL99 | 3 |
Опыт работы свидетельствует о возможности его использования как при диагностике врожденного, так и приобретенного герпеса. Данный тест в сочетании с методами РИФ или ПЦР представляет весьма ценную для врача информацию, особенно при мониторинге врожденных и приобретенных форм, в том числе генитального герпеса, однако требует определенного опыта и знаний в интерпретации результатов. При выдаче заключения следует учитывать, с какой целью и на каком этапе обследуется пациент (с целью диагностики, на этапе наблюдения или проводится оценка эффективности лечения).
Интерпретация результатов исследований на эпштейна-барр-вирусную инфекцию
ВЭБ является основным вирусом, вызывающем в большинстве случаев острое заболевание – инфекционный мононуклеоз, проявляющийся лихорадкой, лимфаденопатией, воспалительными заболеваниями носоглотки, увеличением печени и селезенки, иногда только сыпью или только лихорадкой, и характерными изменениями гемограммы в виде мононуклеарной реакции. При инфекционном мононуклеозе возможны высыпания на коже полиморфного характера и поражение ЦНС в виде менингита, менингоэнцефалита, энцефаломиелита; нередко появляется желтуха. Следует отметить следующие особенности инфекционного мононуклеоза на современном этапе:
1) возросло число атипичных и тяжелых форм;
2) заболевание стало часто регистрироваться у лиц молодого возраста (от 15 лет до 30 лет);
3) участились случаи лимфаденопатии и субфебрилитета, в том числе и у беременных женщин, связанные с активацией ВЭБ при отсутствии (или позднем появлении) в гемограмме атипичных мононуклеаров;
4) часто стали отмечаться у детей и лиц молодого возраста осложнения после перенесенной типичной формы инфекционного мононуклеоза в виде персистирующей инфекции, паратонзиллярного абсцесса, фурункулеза;
5) доказана роль ВЭБ в формировании патологии эмбриона (плода) и новорожденного, нередко с поражением ЦНС.
Диагностика основывается на клинических, эпидемиологических и лабораторных данных. В связи с полиморфизмом клинических проявлений большое диагностическое значение имеет правильная оценка изменений в периферической крови. Для подтверждения диагноза используются различные серологические методы и ПЦР. Наибольшее значение имеет обнаружение ДНК и/или антител класса IgM и (или) IgА к вирусному капсиду и “ранних” IgG. IgM появляются с началом болезни и сохраняются 1-2 месяца,
в дальнейшем идет переключение синтеза на IgА (чаще свидетельствуют о реактивации). Антитела к ядерным антигенам вируса IgG появляются лишь через 3-6 недель от начала болезни и сохраняются в течение всей жизни. Их определение имеет ретроспективное значение.
Выявление атипичных мононуклеаров при световой микроскопии – является основным методом, доступным любой клинико-диагностической лаборатории. Они обычно появляются с первых дней заболевания и наиболее выражены в период разгара болезни. Иногда они появляются позднее. Диагностическое значение имеет обнаружение широкоплазменных атипичных мононуклеаров при увеличении общего числа лимфоцитов. В процессе лечения на фоне иммуномодуляции у пациентов, у которых отсутствовали атипичные мононуклеары или имелись единичные, возможно их появление (увеличение).
ИФА используется на первом этапе диагностического процесса и для мониторинга, позволяет определить в сыворотке крови специфические антитела IgM, IgА и IgG (“ранние” и “поздние”). Для диагностики и установления активности инфекционного процесса важно выявить IgM, IgА и/или “ранние” IgG. Наблюдение в динамике за специфическим иммунным ответом позволяет оценить эффективность проводимой терапии. Длительное или периодически положительные результаты на наличие “ранних” IgG свидетельствуют о персистирующей форме и возможной периодической реактивации вируса. Дополнительную информацию дает метод иммуноблота.
Иммуноблот (Westernblot) – позволяет раздельно определять IgM и IgG к отдельным белкам (наборы фирмы “EUROIMMUN”, Германия), поскольку на одном стрипе нанесен полный набор антигенов. Это позволяет надежно выявлять стадию инфекции, что чрезвычайно важно не только для диагностики, но и для клинико-иммунологического мониторинга, особенно у переболевших типичной формой инфекционного мононуклеоза с учетом высокой частоты персистенции вируса. Выявление белка VСА 125 указывает на раннюю фазу инфекции.
Специфичность антигенов на стрипе
| Полоса | Молекулярная масса | Антиген | Специфичность |
| gC-1 | 130 кДа | Гликопротеин С-1 (gC-1) ВПГ-1 | Высокоспецифичен для вируса простого герпеса 1 типа |
| gB-1 | 120 кДа | Гликопротеин B-1 (gB -1) ВПГ-1 | Специфичен для вирусов простого герпеса |
| gD-1 | 60 кДа | Гликопротеин D-1 (gD -1) ВПГ-1 | Специфичен для вирусов простого герпеса |
| gG-2 | Гликопротеин G-2 (gG-2) ВПГ-2 | Высокоспецифичен для вируса простого герпеса 2 типа |
В разгаре болезни и на этапе завершения острого процесса появляются VСА 19. О поздней фазе свидетельствует высокоспецифичный маркер VСА 22, который выявляется самостоятельно или совместно с EBNA-1 (р79). Последний белок длительно присутствует о переболевших и свидетельствует о перенесенной инфекции. При проведении клинико-иммунологического мониторинга нами показано, что отсутствие антител к р79 у детей после перенесенного инфекционного мононуклеоза (тяжелая форма) коррелирует с наличием ДНК данного вируса в соскобах со слизистой зева и (или) в лейкоцитарной взвеси и клинически сопровождается частыми рецидивами ангин.
При выявлении ДНК вируса в лейкоцитарной взвеси или из очага инфекции (соскоб со слизистой носоглоточного кольца) целесообразно провести серологические исследования для установления факта первичной инфекции или рецидива заболевания. При наличии IgM можно делать заключение об острой инфекции, в случае выявления IgА либо “ранних” IgG – о реактивации, а “поздних” белков – о персистенции.
Таким образом, возможности лаборатории вполне достаточны для диагностики герпесвирусных инфекций с учетом принципа рациональности и экономической и клинической целесообразности.
ЛИТЕРАТУРА
1. Агаджанова Е.А., Новикова С.В., Малиновская В.В. и др. К вопросу о диагностике и лечебной тактике у беременных с герпесвирусной инфекцией // Российский вестник акушера-гинеколога. – 2011. – № 4. – С. 56-58.
2. Агаркова Л. А., Бухарина И. Ю., Габитова Н. А. Опыт использования современных алгоритмов диагностики и лечения перинатально значимых инфекций у женщин с невынашиванием беременности // Сибирский медицинский журнал. – 2008. – № 4. – С. 11-14.
3. Буданов П.В., Стрижаков А.Н. Этиология, патогенез, диагностика и лечение внутриутробной инфекции. // Вопросы гинекологии, акушерства и перинатологии. – 2010. – Т. 9, № 3. – С. 61-71.
4. Гервазиева В. Б., Самойликов П. В. Взаимодействие вирусов семейства Herpesviridae с иммунной системой человека // Аллергология и иммунология. – 2010. – Т. 11, № 1. – С. 31-41.
5. Долгих Т.И. Лабораторная диагностика – основа информационного обеспечения диагностического процесса при оппортунистических инфекциях // Клиническая лабораторная диагностика. – 2008. – № 1. – С. 49 – 51.
6. Долгих Т.И, Шелев М.В., Минакова Е.Ю. Современная стратегия лабораторной диагностики герпесвирусных инфекций // Современная лабораторная диагностика. – 2011. – № 3. – С. 19-22.
7. Кудин А. П., Германенко И. Г., Астапов А. А. Роль Herpes simplex в патологии человека // Медицинские новости. – 2004. – № 5. – С. 11-14.
8. Подколзова Н.М., Скворцова М.Ю., Мельникова Н.И., Острейков И.Ф. Внутриутробная инфекция: современное состояние проблемы // Акушерство и гинекология. – 2009. – № 3. – С. 27-32.
9. Anzivino E., Fioriti D., Mischitelli M. et al. Herpes Simplex Virus Infections in pregnancy and in neonate: status of art of epidemiology, diagnosis, therapy and prevention //Virology J. – 2009. – 40 (6). – P. 1-11.
10. Cimolai N., Thomas E.E., Tan R., Hill A. Utilization of herpes simplex PSA assays for cerebrospinal fluid in a pediatric health care setting. // Can. J. Microbiol. – 2001. – 47 (5). – P. 392-396.
11. Kimberlin David W. Herpes Simplex Virus Infections of Newborn // Curr.
Probl. Pediatr. Adolesc Health Care. – 2009. – № 39. – Р. 7-23.
Как передается заболевание?
Это нужно знать для того, чтобы правильно назначить диагностику. Путей передачи много. Вирус может находиться на любом участке кожи или слизистой оболочки, то есть там, где есть эпителиальные клетки.
Наиболее частые способы передачи вируса папилломы человека:
- Половой вагинальный контакт.
- Анальный секс.
- Оральный секс (кунилингус в том числе) — возможно инфицирование глотки и гортани с развитием онкологии этих органов.
- Поцелуй при наличии микротравм слизистой оболочки.
- От матери к плоду при прохождении через родовые пути.
- При тесном контакте поврежденных кожных покровов с папилломами другого человека. Повреждения могут быть не заметны и часто образуются при половом контакте в области лобка, мошонки, половых губ, что дает возможность заражения ВПЧ при использовании презерватива.
- Передача вируса с поверхности бородавок на поврежденную кожу.
Папилломавирус 16/18 (качественный метод)
Папилломавирусная инфекция – это общее название ряда вирусных заболеваний, характерной особенностью которых является образование на поверхности кожи и слизистых оболочек наростов, похожих на бородавки. Инфекции этого ряда хронические, с периодическими рецидивами, очень заразные и широко распространенные. Вызываются заболевания вирусом папилломы человека (ВПЧ), имеющего более 100 известных медицине генотипов. Заражение вирусом происходит, как правило, при половом акте, однако известны случаи инфицирования детей от больных матерей во время родов.
Далеко не всегда вирус папилломы человека дает о себе знать видимым образом. Известны случаи полного самопроизвольного исчезновения вируса из организма (особенно это свойственно молодым людям). Однако долгая локализация агента инфекции в ткани, покрывающей поверхность матки (эпителии), чревата возникновением аномальных изменений.
Болезни, вызываемые вирусом папилломы, разнообразны и зависят от его типа. Следствием заражения ВПЧ на определенном этапе может быть поражение среднего слоя эпителия, характеризуемое образованием как бы чешуйчатой трансформации клеток шейки матки. Возникновение третьей стадии данного состояния становится возможным только при постоянном пребывании возбудителя инфекции, относящегося к генотипу с высокой онкологической степенью риска. Есть сведения, что наличие таких генотипов в течение 5-10 лет в организме женщин от 30 лет, значительно увеличивает риск возникновения онкологических новообразований шейки матки. По статистике больше 90% случаев онкологии канала шейки матки характеризуются присутствием вируса папилломы. Чаще всего из обнаруживаемых типов встречаются 16-й и 18-й. Их выявление при исследовании пробы еще не означает наличие рака, но служит сигналом для дальнейших обследований и наблюдения за поведением инфекции.
Следствием инфицирования вирусом папилломы человека может быть не только образование раковой опухоли женских половых органов, но и развитие плоскоклеточного рака у представителей обоих полов. Также проведенные исследования доказали непосредственную причастность вируса к образованию:
- кондилом – образований, являющихся результатом разрастания кожи или слизистой оболочки в виде сосочка в местах раздражения, трения, в т.ч. в области гениталий;
- остроконечных кондилом (разновидности кондилом) – небольших выростов, имеющих цвет тела и образующихся на гениталиях, вокруг заднего прохода, изредка в ротовой полости.
Данное тестирование предназначено для выявления специфических фрагментов ДНК 16-го и 18-го типов вируса папилломы человека. Исследование проводится методом полимеразной цепной реакции, суть которого заключается в значительном увеличении количества специфических для ВПЧ фрагментов ДНК вируса с наблюдением за процессом в режиме реального времени. Материал, отбираемый для исследования – клетки эпителиальной ткани урогенитального тракта.
Получение корректного результата исследования возможно только в том случае, когда отбор пробы эпителиальных клеток урогенитального тракта проведен строго в соответствии с техническими требованиями. Определить это позволяет дополнительный показатель – КВМ (контроль взятия материала), позволяющий выяснить, какое количество специфических фрагментов ДНК вируса попало в пробу с эпителиальными клетками.
Аналитические показатели:
- исследуемый участок: фрагменты ДНК, характерные для ВПЧ типов 16, 18;
- специфичность теста – 100%;
- чувствительность определения для названных выше типов вируса папилломы человека – 100 копий ДНК в исследуемой пробе.
Профилактика вируса
Профилактировать можно как первичное инфицирование, так и заражение здорового полового партнера, а также рецидивирование папилломавирусной инфекции.
Чтобы вирус не попал во время полового акта необходимо использовать презерватив и исключить контакт кожных покровов здорового человека с участками, где есть папилломы у инфицированного.
Уменьшить риск заражения поможет своевременное удаление проявлений папилломавирусной инфекции — папиллом и кондилом. Это, конечно, не избавляет полностью от ВПЧ, но снижает его количество на поверхности кожи. Помочь также может противовирусная и иммуномодулирующая терапия, направленная против вируса папилломы человека.
У подростков, не вступавших в половой контакт и не имеющих генитальных типов ВПЧ, для профилактики используется специальная вакцина, которая позволяет иммунной системе выработать антитела против вируса, что препятствует его фиксации в клетках, если заражение происходит в будущем. Это позволяет снизить риск рака шейки матки, который очень часто связан с папилломавирусом.
Профилактикой кожных папиллом может служить своевременная обработка царапин, ссадин, потертостей, мозолей и других повреждений кожи антисептиками, что позволяет закрыть входные ворота для вируса при тактильном контакте с больным человеком.
Папилломавирус генотипирование (16,18,31,33,35;39,45,51,52,56,58,59) (качественный метод)
Папилломавирусная инфекция – это общее название ряда вирусных заболеваний, характерной особенностью которых является образование на поверхности кожи и слизистых оболочек наростов, похожих на бородавки. Инфекции этого ряда хронические, с периодическими рецидивами, очень заразные и широко распространенные. Вызываются заболевания вирусом папилломы человека (ВПЧ), имеющего более 100 известных медицине генотипов. Заражение вирусом происходит, как правило, при половом акте, однако известны случаи инфицирования детей от больных матерей во время родов, а также передачи инфекции при бытовых контактах.
Наиболее вероятно заражение папилломавирусной инфекцией:
- при раннем начале половой жизни;
- при большом количестве половых партнеров;
- при низкой иммунной защите;
- при использовании пероральных противозачаточных средств;
- при авитаминозе;
- при наличии инфекций, передаваемых половым путем;
- при пристрастии к курению;
- при проживании в больших городах.
Зависимость вероятности инфицирования от количества половых партнеров можно проиллюстрировать следующими данными наблюдений: среди женщин, имеющих одного партнера, количество инфицированных вирусом составляется 17-20%, пяти и более партнеров – порядка 70-80%.
Длительность инкубационного периода ВПЧ может варьироваться от 2 месяцев до 10 лет. Как правило, инфекция протекает бессимптомно. Даже проведение кольпоскопического, цитологического и гистологического обследования могут показывать норму. Скрытую форму инфицирования вирусом папилломы человека можно выявить только методом ПЦР.
Почти у трети пациентов инфекция самопроизвольно исчезает из организма в течение полугода-года (особенно это свойственно молодым людям).
Болезни, вызываемые вирусом папилломы, разнообразны и зависят от его типа. Следствием заражения ВПЧ на определенном этапе может быть поражение среднего слоя эпителия, характеризуемое образованием как бы чешуйчатой трансформации клеток шейки матки. Развитие третьей стадии данного состояния становится возможным только при постоянном пребывании возбудителя инфекции, относящегося к генотипу с высокой онкологической степенью риска. Есть сведения, что наличие таких генотипов в течение 5-10 лет в организме женщин от 30 лет, значительно увеличивает риск возникновения онкологических новообразований шейки матки. Поражение вирусом папилломы человека клеток трофобласта (наружного слоя клеток зародыша) может привести к самопроизвольному аборту.
Следствием инфицирования ВПЧ может быть не только образование раковой опухоли женских половых органов, но и развитие плоскоклеточного рака у представителей обоих полов. Также проведенные исследования доказали непосредственную причастность вируса к появлению:
- кондилом – образований, являющихся результатом разрастания кожи или слизистой оболочки в виде сосочка в местах раздражения, трения, в т.ч. в области гениталий;
- остроконечных кондилом (разновидности кондилом) – небольших выростов, имеющих цвет тела и образующихся на гениталиях, вокруг заднего прохода, изредка в ротовой полости;
- бородавок.
Эти образования являются доброкачественными и появляются при острой инфекции. Заражение ВПЧ детей чревато развитием папилломатоза гортани.
Причиной инфицирования мужчин в 40-60% случаев являются половые контакты с инфицированной женщиной. При проведении исследования у них обнаруживаются те же генотипы ВПЧ, что и у партнерш. Папилломавирус у лиц мужского пола может проявляться характерными высыпаниями на коже и слизистых оболочках половых органов.
Данное тестирование предназначено для выявления специфических фрагментов ДНК 16, 18, 31, 33, 35; 39, 45, 51, 52, 56, 58, 59 типов вируса папилломы человека. Исследование проводится методом полимеразной цепной реакции (ПЦР), суть которого заключается в значительном увеличении количества специфических для ВПЧ фрагментов ДНК вируса с наблюдением за процессом в режиме реального времени. Материал, отбираемый для исследования – эпителиальные клетки урогенитального тракта.
Выявление при исследовании генотипов вируса папилломы человека с высокой онкологической степенью риска еще не означает наличие рака, но является показанием для дополнительного проведения гистологического, цитологического исследований и наблюдения за развитием инфекции в динамике.
Важность проведения повторного генотипирования обусловлена следующими аргументами:
1. Присутствие в организме нескольких генотипов вируса папилломы человека является показателем вероятности более тяжелого протекания инфекции с более высоким риском сохранения вируса в активном состоянии;
2. Различные генотипы характеризуются различной степенью канцерогенной активности. Наиболее опасными являются 16 и 18 тип ВПЧ. При обнаружении специфических фрагментов ДНК ВПЧ после теста на широкий спектр типов, необходимо проведение исследование на выявление 16 и 18 генотипов. Подтверждение их наличия является показанием к проведению кольпоскопии. Если при повторном обследовании обнаружены другие генотипы высокого онкологического риска, рекомендуется проведение цитологических исследований, а затем, в случае получения положительного ответа – кольпоскопии.
3. Повторное генотипирование дает возможность определить, что именно имеет место: реинфицирование или персистентная (хроническая) инфекция (в первом случае спектр генотипов изменяется, во втором – генотип остается тот же). Это важно знать, поскольку хроническая форма представляет значительную опасность, в то время как недавнее инфицирование может самопроизвольно излечиться. К тому же повторное заражение одним и тем же генотипом после самопроизвольного излечения практически невозможно.
Получение корректного результата исследования возможно только в том случае, когда отбор пробы эпителиальных клеток урогенитального тракта проведен строго в соответствии с техническими требованиями. Определить это позволяет дополнительный показатель – КВМ (контроль взятия материала), позволяющий выяснить, какое количество специфических фрагментов ДНК вируса попало в пробу с эпителиальными клетками.
Аналитические показатели:
- исследуемый участок: фрагменты ДНК, характерные для ВПЧ типов 16, 18;
- специфичность теста – 100%;
- чувствительность определения для названных выше типов вируса папилломы человека – 100 копий ДНК в исследуемой пробе.
Сдать анализ на ВПЧ в Москве у нас
Для планирования профилактических методов, конечно же, важна диагностика ВПЧ. Необходимо знать, есть этот вирус у Вас или нет, чтобы понимать риски для половых партнеров и перспективы развития этого заболевания. Поэтому, даже, если нет никаких проявлений, анализы на папилломавирусы необходимы при полноценном обследовании у уролога или гинеколога.
Где можно сдать анализы на ВПЧ: ежедневно с 10:00 до 21:00 в наших клиниках без выходных и в праздничные дни. При необходимости можно получить исчерпывающую консультацию по диагностике и лечению папилломавирусной инфекции опытных врачей урологов, гинекологов и венерологов.