Хроническая крапивница: препарат выбора
Хр
оническая идиопатическая крапивница (ХИК) – это заболевание кожи, которым страдает 0,1–3% населения. ХИК поражает, как правило, лиц трудоспособного возраста, так как начало заболевания чаще приходится на второе и четвертое десятилетия жизни, при этом хотя бы один эпизод крапивницы в течение всей жизни возникает у 15–20% как детского, так и взрослого населения. Хроническую крапивницу в 2 раза чаще диагностируют у женщин среднего возраста, что обусловлено наличием дисгормональных и нейроэндокринных расстройств [1, 2]. Приблизительно у 50% больных хроническая крапивница сочетается с отеком Квинке [3]. У пациентов с ХИК значительно нарушается качество жизни, что выражается в нарушении сна, изменении эмоционального фона, возникновении определенных проблем в повседневной жизни [4, 5]. Крапивница может быть как самостоятельным заболеванием, так и симптомом целого ряда заболеваний. Клинические проявления крапивницы являются результатом высвобождения и синтеза медиаторов, преимущественно тучными клетками, расположенными в коже, к чему приводят иммунные, неиммунные, а также идиопатические факторы. Первичным элементом при крапивнице является волдырь – уртика. При надавливании уртикарный элемент бледнеет, что свидетельствует о наличии в очагах поражения кожи расширенных кровеносных сосудов и отека. Уртикарная сыпь сопровождается зудом, который усиливается ночью и сохраняется от нескольких минут до 48 ч [6]. Спустя указанный срок элементы сыпи бесследно исчезают, однако новые высыпания могут появляться в разное время на других участках тела (рис. 1) [7]. На гистологическом уровне – это отек и периваскулярная инфильтрация лимфоцитами, тучными клетками, эозинофилами и нейтрофилами эпидермиса и верхнего слоя дермы со сдавлением вен и лимфатических сосудов. Крапивница и отек Квинке могут развиваться вместе или раздельно. Если отек охватывает кожу и подкожные ткани, такое состояние определяется как ангионевротический отек, или отек Квинке. При крапивнице в процесс вовлекаются только поверхностные слои кожи. При отеке Квинке зуд выражен меньше, но боль и чувство жжения аналогичны. Крапивница может встречаться на любой части тела, в то время как отек Квинке — чаще на участках, богатых соединительной тканью, на лице, конечностях и гениталиях. В отличие от других форм отека, симметричность его расположения отсутствует (рис. 2) [8].
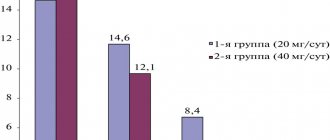
Выделяют острую (до 6 нед.) и хроническую (более 6 нед.) крапивницу. При многократном появлении высыпаний диагностируют рецидивирующую крапивницу. Крапивница наиболее часто связана с пищевой, лекарственной аллергией, а также может быть опосредована глистной инвазией, вирусной инфекцией. При этом у половины больных причину уртикарной сыпи выявить не удается – такая крапивница обозначается, как идиопатическая. Ранее считалось, что крапивница в большинстве своем является идиопатической и составляет 80–95% от всех случаев крапивницы. В литературе последних лет все реже встречается название «идиопатическая крапивница», более распространенным стал термин «хроническая крапивница», так как в процессе многолетнего наблюдения за больными с ранее установленным диагнозом «идиопатическая крапивница» многими исследователями в 35-55% случаев был выявлен аутоиммунный генез [7, 8]. Хроническая крапивница также может быть опосредована паразитами, что объясняется их стимулирующей ролью в развитии IgE-иммунного ответа, однако, клиническое разрешение крапивницы путем элиминации паразитов достигается лишь в 8–16% случаев [9]. Одной из причин повышенной активации тучных клеток у больных хронической крапивницей называют часто выявляющуюся инфекционно-воспалительную патологию органов пищеварительного тракта. Инфекция Helicobacter pylori также рассматривается в связи с хронической крапивницей. Установлено, что частота ее выявления среди больных крапивницей и в популяции одинакова. Однако иммунный ответ на H. pylori у пациентов с крапивницей может отличаться. Более того, анализ существующих исследований выявил, что ремиссия крапивницы более вероятна в тех случаях, когда антибактериальная терапия приводит к иррадикации H. pylori [10]. У части больных обнаружено сочетание хронической крапивницы с аутоиммунной патологией щитовидной железы, сопровождающейся выявлением в сыворотке антитиреоидных антител, которые могут быть маркером аутоиммунного характера, однако механизмы связи антитиреодных аутоантител с активацией тучной клетки остаются неясными [11]. При ХИК уртикарные элементы сохраняются дольше, чем при различного рода физической крапивнице, – обычно до 8–12 ч и сопровождаются более выраженным зудом, особенно вечером и ночью. При ХИК у 25–45% больных обнаруживают признаки аутоиммунного заболевания. У таких больных уровень сывороточного иммуноглобулина Е (IgЕ) существенно ниже, а к обильной и распространенной уртикарной сыпи добавляется выраженный зуд [12]. При исследовании биоптатов кожи у пациентов с ХИК и наличием FcεRI/IgE-антител нередко выявляют периваскулярные инфильтраты, в основном состоящие из нейтрофилов, эозинофилов и мононуклеарных клеток [13, 14]. Почти у трети больных ХИК выявляются аутоиммунные реакции на ткань щитовидной железы. При этом у большинства из них отсутствуют какие-либо клинические симптомы поражения щитовидной железы и изменение уровней гормонов, отмечается уменьшение или исчезновение симптомов крапивницы после назначения L-тироксина [11, 14–16]. Помимо оценки анамнеза, клинических симптомов заболевания и его течения, в проведении дифференциальной диагностики хронических крапивниц помогают лабораторные исследования: • кожные тесты или определение специфических IgЕ-антител в крови позволяют выявить связь сыпи с едой, лекарственными препаратами, укусами насекомых, пыльцой растений, животными; • посев при наличии хронического очага воспаления для выделения культуры бактерий и определения их чувствительности; • исследование функции щитовидной железы; • анализ кала на яйца гельминтов; • тесты на наличие аутоантител; • общий анализ крови, СОЭ, определение С-реактивного белка; • выявление H. pylori [17] . Основными препаратами в лечении хронической крапивницы служат антигистаминные препараты. Несмотря на то, что антигистаминные средства I поколения (дифенгидрамин, гидроксизин и т. д.) эффективно устраняют симптомы крапивницы, их назначение сопряжено с возникновением большого числа побочных эффектов. К ним относятся сонливость, антихолинергический эффект (сухость слизистых оболочек, головокружение, запор, задержка мочеиспускания и др.), нарушение памяти, внимания, которые могут сохраняться в течение суток после приема препарата. В соответствии с Международным руководством по лечению крапивницы (EAACI/GA2LEN/ EDF/WAO management guideline) антигистаминные препараты I поколения (седативные) не должны использоваться в качестве первоочередного лечения больных крапивницей. Исключением могут быть только те ситуации, когда невозможно использовать антигистаминные препараты II поколения. В настоящее время первоочередным считается назначение неседативных антигистаминных препаратов II поколения. Эти препараты, лишенные побочных эффектов, присущих антигистаминным средствам I поколения, не менее эффективно блокируют Н1-рецепторы к гистамину и подавляют симптомы крапивницы, существенно улучшая качество жизни больных [18, 19]. Среди «неседативных» антигистаминных препаратов особого внимания заслуживает дезлоратадин (Элизей), являющийся первичным фармакологически активным метаболитом хорошо известного лоратадина. Дезлоратадин – препарат, поступающий в организм в виде активного вещества, что обеспечивает его более высокий профиль безопасности. Он был синтезирован в 1998 г., в России зарегистрирован в 2001 г. Дезлоратадин обладает способностью подавлять острую фазу аллергического ответа за счет блокирования H1-рецепторов. В экспериментальных исследованиях было показано, что дезлоратадин отличается наибольшим сродством к Н1-гистаминовым рецепторам и медленной диссоциацией из связи с ними. Дезлоратадин неконкурентно связывается с H1-рецепторами и, по данным клинических исследований, обладает в 52, 57, 194 и 153 раза более высокой активностью, чем цетиризин, эбастин, фексофенадин и лоратадин соответственно. Препарат быстро всасывается после приема внутрь и характеризуется большой скоростью достижения максимальной плазменной концентрации и быстрым началом действия (через 1,25–3,00 ч). Фармакокинетика дезлоратадина линейна и пропорциональна дозе. Период полувыведения препарата составляет 21–24 ч, что позволяет назначать его 1 раз в сутки. Прием пищи не оказывает влияния на скорость и степень всасывания препарата. Выявлено, что фармакокинетика и биодоступность дезлоратадина одинаковы при приеме препарата натощак и после стандартизированной пищи у здоровых людей (максимальная концентрация натощак и после еды составила 3,30 и 3,53 нг/мл соответственно, р=0,17). Следовательно, препарат можно принимать независимо от приема пищи, что свидетельствует об удобстве его применения. Метаболизм и выведение препарата не зависят от возраста и пола больного [20–24]. Исследования на животных in vitro и in vivo продемонстрировали, что дезлоратадин, ингибируя ряд медиаторов воспаления, обладает дополнительными антиаллергическими и противовоспалительными эффектами, не связанными с блокадой Н1-гистаминовых рецепторов. В физиологической концентрации препарат эффективно угнетает продукцию гистаминозависимых провоспалительных цитокинов – ИЛ-6 и ИЛ-8, которые, как известно, высвобождаясь из эндотелиальных клеток, базофилов и тучных клеток, стимулируют секрецию провоспалительных медиаторов, таких как фактор некроза опухоли α. Дезлоратадин оказывает влияние на активацию и выживание эозинофилов. Эозинофилы, являясь ключевыми эффекторными клетками в аллергической реакции, продуцируют цитокины, хемокины, лейко-триены и нейромодуляторы. Кроме того, дезлоратадин за счет обратного агонизма снижает экспрессию ядерного фактора κB (NF-κB), известного в качестве индуктора RANTES, главного аттрактанта для эозинофилов, моноцитов и Т-лимфоцитов, способствующего активации эозинофилов и высвобождению гистамина из базофилов. Дезлоратадин сильнее других антигистаминных препаратов ингибирует активность NF-κB, стимулирующего высвобождение провоспалительных медиаторов из базофилов и тучных клеток. По этому эффекту препарат превосходит цетиризин, лоратадин и фексофенадин. Последние исследования показали, что дезлоратадин может также ингибировать дегрануляцию тучных клеток и последующее высвобождение гистамина. Кроме того, дезлоратадин ингибирует экспрессию Р-селектина, индуцируемую гистамином [25–27]. Дезлоратадин характеризуется высоким уровнем безопасности при его применении. Он не вызывает негативных изменений со стороны сердечно-сосудистой системы и других органов, не обладает снотворным действием и не влияет на когнитивные функции. Препарат может применяться пациентами с патологией гепатобилиарной системы и заболеваниями почек, разрешен к применению у детей с 1 года [23, 24]. В ряду представителей антигистаминных препаратов II поколения дезлоратадин выделяется более чем 15-летним успешным опытом широкого медицинского применения и большой доказательной базой. Эффективность и безопасность дезлоратадина в лечении больных ХИК доказаны многочисленными рандомизированными плацебо-контролируемыми клиническими исследованиями. J. Ring, R. Hein, A. Gauger провели многоцентровое двойное слепое плацебо-контролируемое исследование, включавшее 190 пациентов со среднетяжелой и тяжелой ХИК. При обострении заболевания 1-й группе пациентов назначали дезлоратадин 5 мг/сут, 2-й группе – плацебо (контроль). Длительность лечения достигала 6 нед. Первичным критерием эффективности была средняя динамика индекса зуда в течение первых 7 дней лечения по сравнению с исходным показателем. Выявлено, что в течение 1-й недели у больных, получавших дезлоратадин, индекс зуда уменьшился на 56%, а в контрольной группе – на 22%, отмечено также более быстрое регрессирование высыпаний на коже, чем в контрольной группе. Обнаружено, что у пациентов из 1-й группы в конце 1-й недели лечения степень нарушения сна при применении препарата уменьшилась на 53%, а у пациентов из 2-й группы – только на 18%. Через 6 нед. на фоне лечения препаратом индекс зуда уменьшился на 74%, а на фоне приема плацебо – на 48,7%. К концу исследования у пациентов, принимавших дезлоратадин, степень нарушения сна уменьшилась почти на 80%. Как больные, так и врачи высоко оценили общую положительную динамику симптомов ХИК и ответ на лечение дезлоратадином. Частота нежелательных явлений была сопоставима в 2-х группах, серьезных нежелательных реакций не зарегистрировано [28]. В более позднем исследовании 137 больных со среднетяжелой и тяжелой формой ХИК были рандомизированы на 2 группы. Пациентам из 1-й группы назначали дезлоратадин 5 мг/сут, из 2-й – плацебо в течение 6 нед. К концу исследования индекс зуда в группе дезлоратадина уменьшился на 1,43, а в группе плацебо – на 0,86 (р=0,004). Через 6 нед. количество больных с полным, значительным или умеренным ответом на лечение было выше в группе больных, получавших дезлоратадин, по сравнению с пациентами, получавшими плацебо (68,8 и 36,8% соответственно). Серьезных нежелательных явлений не зарегистрировано, а частота любых нежелательных реакций составила 11,1% в группе плацебо и 6,2% в группе дезлоратадина [29]. В другом исследовании было показано, что дезлоратадин уменьшал выраженность основных клинических симптомов ХИК, прежде всего зуда, на 50–70%. Действие препарата продолжалось до 24 ч. Уменьшение симптомов зуда в конце интервала приема дезлоратадина отмечалось у 45% пациентов (против 4% принимавших плацебо) и после 6 нед. приема – у 69%. Также наблюдалось достоверное уменьшение размеров и числа пузырей на фоне терапии дезлоратадином при его длительном применении. Пациенты отмечали улучшение сна на 80%. Оценка качества жизни у пациентов с ХИК на фоне приема препарата в течение 7 дней показала снижение баллов по шкале опросника Dermatology Life Quality Index (DLQI) c 13,4 до 9,1. У 60% больных в течение указанного срока индекс DLQI уменьшился в среднем на 2 балла. К концу исследования доля таких пациентов достигла 77% (р<0,0001) [30]. В Германии в 2001–2002 гг. обследовалось 77 800 пациентов старше 12 лет. Симптомы аллергических заболеваний оценивались до и после лечения. В результате лечения дезлоратадином у подавляющего числа пациентов наблюдалось купирование симптомов, что свидетельствовало о выраженном клиническом эффекте [31]. В клиническом исследовании с включением 12 050 пациентов была подтверждена высокая терапевтическая эффективность дезлоратадина при ХИК. При этом было отмечено отсутствие седативного влияния и сохранность психомоторных функций [32]. В России также был проведен ряд исследований под руководством Ю.В. Сергеева, Н.В. Кунгурова, И.М. Корсунской и соавт., направленных на оценку эффективности применения дезлоратадина в терапии различных дерматозов, сопровождающихся зудом. Проводимая терапия дезлоратадином дала положительный эффект в виде уменьшения зуда или его полного регресса у 90% пациентов. Побочных эффектов при проведении лечения дезлоратадином отмечено не было [33–35]. Дезлоратадин удовлетворяет всем критериям ARIA/EAACI и рекомендуется в качестве первой линии лечения аллергодерматозов [36, 37]. Он обладает особыми фармакокинетическими свойствами: быстро абсорбируется, на его биодоступность не влияет прием пищи, соков. Период полураспада дезлоратадина составляет 21–27 ч, что позволяет сохранять его терапевтическую активность неизменной при однократном приеме в сутки (в отличие от других антигистаминных препаратов II поколения). Более того, исследование совместимости дезлоратадина с другими лекарственными препаратами не выявило каких-либо значимых взаимодействий. Отличительной особенностью дезлоратадина от других противоаллергических препаратов II поколения является тройной механизм действия: он не только блокирует Н1-гистаминовые рецепторы, но и обладает выраженной противоаллергической и противовоспалительной активностью посредством ингибирования синтеза множества других медиаторов тучными клетками, базофилами и другими клетками, участвующими в развитии воспаления [38]. Дезлоратадин тормозит развитие не только ранней, но и поздней фазы аллергической реакции, которая связана с накоплением «клеток воспаления» в очаге поражения. Этот уникальный фармакологический эффект дезлоратадина подавляет формирование хронического воспаления, которое при отсутствии адекватной терапии может привести к затяжному течению болезни. Дополнительным подтверждением противовоспалительной активности дезлоратадина, связанной с подавлением не только аллергического воспаления, является его способность тормозить развитие эритемы при воздействии ультрафиолетового излучения В-диапазона [39]. Клиническая эффективность и безопасность дезлоратадина при хронической крапивнице была доказана при проведении мультицентровых рандомизированных плацебо-контролируемых исследований с помощью двойного слепого метода. Эффективность в отношении подавления зуда отмечалась с первого дня применения препарата и сохранялась в течение последующих 6 нед. Кроме того, лечение дезлоратадином приводило к устранению или существенному уменьшению выраженности таких симптомов ХИК, как нарушение сна, снижение активности и работоспособности пациентов. При этом побочные эффекты отсутствовали [40]. Одним из препаратов, широко применяемым в клинической практике, является Элизей (дезлоратадин 5 мг). Так как хроническая крапивница заболевание длительное и рецидивирующее, то препарат выгоден с фармакоэкономической позиции. Обладает противоаллергическим, противозудным и противоэкссудативным действием. Эффективное купирование симптомов крапивницы при назначении Элизея в дозировке 5 мг наступает уже в первые сутки лечения, продолжается весь период применения препарата и заключается в быстром и стойком уменьшении сыпи, зуда, улучшении сна и активности пациентов в дневное время, т.е. применение Элизея при хронической крапивнице сопровождается существенным улучшением качества жизни больных. У Элизея практически отсутствует седативный эффект, препарат не влияет на когнитивные функции (чтение, вождение). Элизей назначается с 12 лет, в дозировке 5 мг (1 таблетка), один раз в сутки, независимо от приема еды. Длительность приема зависит от степени тяжести и формы крапивницы. Высокая степень безопасности и хорошая переносимость дают основание рекомендовать Элизей для лечения пациентов, страдающих хронической крапивницей.
Классификация
Современные варианты классификации крапивницы основаны на продолжительности симптомов заболевания, причинах его развития и учитывают влияние триггерных факторов [1, 2]. Так, острая крапивница определяется как повторяющееся появление волдырей с ангионевротическим отеком или без него в течение не более 6 нед. Хроническая крапивница рецидивирует на протяжении более 6 нед. При этом примерно в 10–20% случаев ангионевротический отек может быть первым и единственным проявлением крапивницы. Около 60% больных хронической спонтанной крапивницей сообщают об эпизодах ангионевротического отека [3]. Кроме проявлений на коже, крапивница может сопровождаться болью, отечностью суставов (55,3%), головной болью/общим недомоганием (47,6%), ощущением жара (42,7%), хрипами или одышкой (30,1%), желудочно-кишечными расстройствами (26,2%), учащенным сердцебиением (9,7%) [4].
Крапивницу подразделяют на спонтанную или хроническую индуцированную. В группе индуцированной крапивницы выделяют формы заболевания, развившиеся под воздействием физических факторов (дермографическая, тепловая, холодовая, солнечная, вибрационная), а также нефизических триггеров (холинергическая, контактная и аквагенная) [2].
Эпидемиология
Данные по распространенности хронической спонтанной крапивницы несколько разнятся. Считается, что риск развития эпизода крапивницы в течение жизни с среднем в популяции составляет от 20 до 25%. При этом поиск потенциального аллергена, послужившего причиной развития крапивницы, является непростой задачей, несмотря на значительные успехи в развитии современной лабораторной диагностики. Так, в 20% случаев развитие острой крапивницы связано с воздействием потенциальных экзогенных аллергенов, таких как продукты питания или лекарственные средства. В 30% случаев возникновение крапивницы обусловлено инфекционными агентами, особенно инфекциями дыхательных путей. Однако причины оставшихся 50% случаев крапивницы остаются невыясненными [5].
В среднем в популяции хроническая крапивница регистрируется приблизительно у 1% лиц [6]. Причем женщины болеют почти в 2 раза чаще, чем мужчины, а дебют заболевания наиболее часто приходится на 3–5-е десятилетия жизни [6]. Среди главных факторов риска развития хронической крапивницы отмечают ожирение, тревожные, диссоциативные и соматоформные расстройства, злокачественные новообразования [7].
Диагностика
Обычно для идентификации крапивницы достаточно внешнего осмотра. Для подбора наиболее эффективного лекарства врач опрашивает пациента о локализации, частоте, длительности высыпаний, возможных причинах. При подозрении на аллергическую природу заболевания назначаются аллергопробы. Если причина появления сыпи — не аллергия, то пациенту требуется комплексное обследование. В ходе него могут быть проведены:
- биохимия крови и общий анализ,
- анализ мочи,
- анализы на половые инфекции, сифилис, герпес,
- УЗИ внутренних органов,
- гастроскопия,
- электрокардиограмма и другие исследования.
Лечение
Лечение аллергической крапивницы обязательно предусматривает исключение контакта с аллергеном. Если иммунную реакцию вызвал прием пищи или вдыхание вещества-раздражителя, то пациенту промывается желудок, нос, рекомендуется диета.
Бороться с аллергией наиболее действенно способна аллерген-специфическая иммунотерапия. Способ основан на введении внутрь увеличивающихся доз аллергена, к которому организм постепенно привыкает и уже не реагирует столь остро. Для облегчения симптомов применяются мази, кремы и гели, антигистаминные препараты, физиотерапевтические методы лечения кожи. Если заболевание имеет другую причину, то лечить крапивницу необходимо в комплексе с основной болезнью, или же бороться с ней как с сопутствующим симптомом.
Причины
Часто высыпания становятся результатом аллергической реакции организма на непривычные продукты или распространенные аллергены: пыль, шерсть животных, косметику, лекарства, укусы насекомых, холод или тепло, химические компоненты.
Сыпь может проявляться и на фоне других заболеваний. Уртикария встречается у людей с проблемами желудочно-кишечного тракта, почечными и печеночными патологиями, гормональными нарушениями, опухолевыми процессами. Иммунитет реагирует крапивной лихорадкой на заражение бактериальными, вирусными и грибковыми инфекциями, а также паразитами.