- Способы диагностирования прыщей стафилококка
- Каково лечение инфекций стафилококка и прыщей?
- Золотистый стафилококк и прыщи
- Лечение золотистого стафилококка и прыщей на лице
- Кто находится под угрозой заражения стафилококком и прыщей?
- Кто подвержен риску заражения стафилококком?
- Является ли прыщи стафилококка инфекционным заболеванием?
- Как долго инфекция стафилококка и ее прыщи являются заразными?
Стафилококк (иногда называемый «стафилококком») представляет собой группу бактерий, которые могут вызывать множество заболеваний, включая тяжелую форму акне и прыщей на разных участках кожи, в том числе на лице.
Инфекции Staph могут вызвать заболевание из-за прямой инфекции или из-за выработки токсинов бактериями Боли, импетиго, пищевое отравление, целлюлит и синдром токсического шока — все это примеры заболеваний, которые могут быть вызваны Стафилококком.
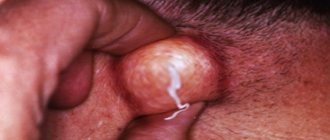
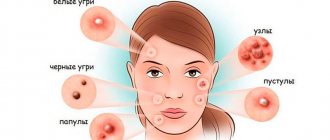
Симптомы и признаки локализованной инфекции стафилококка включают в себя сгустки гноя, таких как при гнойных прыщах, кипениях, фурункулах или абсцессах на коже Область появления инфекции обычно нежная или болезненная и может быть покрасневшей и опухшей.
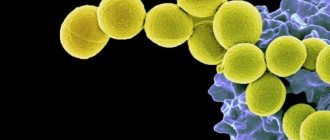
Название Staphylococcus происходит от греческого стафиля, что означает гроздь винограда, и кокко, что означает ягода, и именно так выглядят бактерии стафилококка под микроскопом, похожие на гроздь винограда или маленькие круглые ягоды.
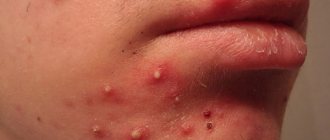
Staph инфекции на лице или теле могут выглядеть как акне, но стафилококк гораздо более тяжелое кожное заболевание, чем обычное акне Один из способов увидеть разницу состоит в том, что стафилококк не будет иметь симметричных границ, таких как прыщ или пустула Если вы подозреваете, что у вас начали провялятся симптомы стафилококка, вам следует немедленно обратиться к врачу для диагностирования соответствующей проблемы.
Более 30 различных типов стафилококков могут инфицировать людей, но большинство инфекций вызвано Staphylococcus aureus Стафилококки обычно встречаются в носу и на коже (и реже в других местах) В большинстве случаев бактерии не вызывают заболевания Однако воспаления как в случае акне, глубокий порез или другое повреждение кожи может позволить бактериям преодолеть естественные защитные механизмы организма, что приведет к дальнейшему развитию инфекции.
Стафилококковая инфекция не является причиной, а скорее является осложнением акне и прыщей, особенно у людей, у которых часто появляются прыщи Угри могут появляться в любом месте на коже, чаще всего на лице, шее, плечах и верхней части спины.
Способы диагностирования прыщей стафилококка
Анализы крови необходимы для диагностики стафилококка, когда возникает сомнение или возникают более серьезные инфекции.
В случаях небольших кожных инфекций и прыщей лечащий врач обычно может диагностировать стафилококковые инфекции по их внешнему виду без необходимости лабораторного тестирования Более серьезные стафилококковые инфекции, такие как инфекция кровотока, пневмония и эндокардит, требуют культивирования образцов крови или инфицированных жидкостей или тканей организма.
Лаборатория устанавливает диагноз и проводит специальные тесты, чтобы определить, какие антибиотики эффективны против подобных бактерий.
Каково лечение инфекций стафилококка и прыщей?
Опрос: Когда появились у Вас прыщи? (Кол-во голосов: 4295)
Всю жизнь мучаюсь
Уже как пару лет
Примерно несколько месяцев
Совсем недавно
Чтобы проголосовать, кликните на нужный вариант ответа. Результаты
Малые инфекции стафилококка и прыщи на коже обычно обрабатывают антибиотической мазью, такой как тройная антибиотическая смесь, которая доступна без рецепта В некоторых случаях могут назначаться пероральные антибиотики для кожных инфекций Кроме того, если имеются абсцессы, они хирургически удаляются Более серьезные и опасные для жизни инфекции лечатся внутривенными антибиотиками и поддерживающей медицинской помощью в больнице.
Врачи используют несколько различных типов антибиотиков, которые использовались для лечения стафилококковых инфекций Выбор антибиотика зависит от типа и тяжести инфекции, а также от образцов лекарственной устойчивости конкретного бактериального типа Некоторые из антибиотиков, которые использовались для лечения стафилококковых инфекций — цефазолин, цефуроксим, цефалексин, нафциллин (налпен), оксациллин (бактоцилл), диклоксациллин, ванкомицин, клиндамицин ( Cleocin), рифампин и теловацин (Vibativ) Также можно использовать комбинации антибиотиков с другими антибиотиками Некоторые виды стафилококка, такие как MRSA все — же остаются устойчивы ко многим антибиотикам.
Прыщи стафилококк под микроскопом фото
Золотистый стафилококк и прыщи
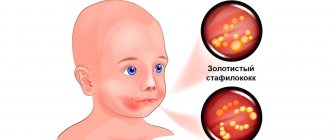
Золотистый стафилококк, который может сопровождать прыщи, является наиболее опасным из всех распространенных стафилококковых бактерий.
Эти бактерии распространяются путем непосредственного контакта с инфицированным человеком с использованием зараженного объекта или путем вдыхания инфицированных капелек, диспергированных чиханием или кашлем.
Кожные инфекции достаточно распространены, а бактерии могут распространяться через кровь и заражать отдаленные органы человека.
Инфекция золотого стафилококка на коже может вызвать помимо прыщей еще волдыри, абсцессы, покраснение и отек в зараженной области.
Диагноз основан на появлении кожи или идентификации бактерий в образце зараженного материала.
Тщательное мытье рук может помочь предотвратить распространение инфекции.
Антибиотики для лечения проблемы выбираются исходя из того, могут ли они быть эффективными против такого вида золотистого стафилококка, вызывающего инфекцию на коже, сопровождающуюся постоянным появлением тяжелых прыщей.
Инфекция золотистого стафилококка в большей степени присутствует в носу, обычно около 30%, и на коже, около 20% Процентные показатели выше для людей, которые находятся в больнице или работают там, а также для людей, склонных к появлению прыщей на коже лица и тела.
Люди, у которых есть бактерии, нокоторые не имеют никаких симптомов, вызванных золотистым стафилококком, называются носителями Люди, которые, скорее всего, являются носителями, включают тех, чья кожа неоднократно подвергалась влиянию кожных инфекций, например:
- Люди, страдающие сахарным диабетом, которые должны регулярно вводить инсулин;
- Люди, употребляющие наркотики;
- Люди, которым назначен гемодиализ или хронический амбулаторный перитонеальный диализ;
- Люди с кожными инфекциями, СПИДом или предыдущими стафилококковыми инфекциями крови.
Люди могут перемещать бактерии из носа в другие части тела руками, иногда приводя к активации более серьезной и активной фазы инфекции.
Бактерии золотистого стафилококка могут распространяться от человека к человеку путем прямого контакта через зараженные объекты (например, оборудование для гимнастики, телефоны, дверные ручки, пульт дистанционного управления телевизором или кнопки лифта) или, реже, путем вдыхания зараженных капель, рассеянных чиханьем или кашлем.
Стафилококк прыщи на лице фото
Литература
- Zipperer A., Konnerth M.C., Laux C., Berscheid A., Janek D., Weidenmaier C. et al. (2016). Human commensals producing a novel antibiotic impair pathogen colonization. Nature. 535, 511–516;
- Dobson A., Cotter P.D., Ross R.P., Hill C. (2012). Bacteriocin production: a probiotic trait? Appl. Environ. Microbiol. 78, 1–6;
- Donia M.S., Cimermancic P., Schulze C.J., Wieland Brown L.C., Martin J., Mitreva M. et al. (2014). A systematic analysis of biosynthetic gene clusters in the human microbiome reveals a common family of antibiotics. Cell. 158, 1402–1414;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Lewis K. and Strandwitz P. (2016). Antibiotics right under our nose. Nature. 535, 501–502;
- Википедия: «Золотистый стафилококк»;
- Карпов И.А. и Качанко Е.Ф. (2005). Стафилококковая инфекция: клинические аспекты и перспективы терапии. Медицинские новости. 9, 53–56;
- Mandal A. (2012). What is Staphylococcus aureus? News-Medical.net;
- Naber C.K. (2009). Staphylococcus aureus bacteremia: epidemiology, pathophysiology, and management strategies. Clin. Infect. Dis. 48, S231–S237;
- Стафилококк золотистый (Staphylococcus aureus). ГастроСкан;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Википедия: «Нерибосомные пептиды»;
- Caboche S., Pupin M., Leclère V., Fontaine A., Jacques P., Kucherov G. (2008). NORINE: a database of nonribosomal peptides. Nucleic Acids Res. 36, D326–D331;
- Mironovskiĭ M.L., Ostash B.E., Fedorenko V.A. (2010). Diversity of genes encoding nonribosomal peptide synthetases in the Streptomyces sioyaensis genome. Genetika. 46, 896–903.
Лечение золотистого стафилококка и прыщей на лице
Антибиотики
Инфекции, вызванные золотистым стафилококком, обрабатываются и лечатся антибиотиками В начале врачи пытаются определить, устойчивы ли бактерии к антибиотикам и, если да, к каким антибиотикам.
Инфекция, которая приобретается в последствии развития прыщей и акне лечится такими антибиотиками, которые эффективны против золотистого стафилококка, как: ванкомицин, линезолид, тедизолид, Quinupristin плюс дальфопристин, цефтаролина, телаванцинаили даптомицина.
Если результаты тестирования позже указывают на то, что кожа чувствительна к метициллину, и у человека нет аллергии на пенициллин, используется лекарственное средство, связанное с метициллином, таким как нафциллин В зависимости от того, насколько серьезной является инфекция, может быть назначен курс лечения антибиотиками, который может длиться начиная от нескольких недель.
Профилактика стафилококковых инфекций
Эффективная профилактика стафилококковых инфекций включает:
- Регулярный ежедневный душ;
- Ношение удобной, не узкой одежды из натуральных тканей без использования синтетики;
- Не разделяйте полотенца и бритвы с другим человеком;
- Чистку спортивного оборудования перед их использованием;
- Избегйте контакта с инфицированными людьми с ярко выраженными гнойными выделениями и прыщами;
- Избегайте царапин на коже, а также выдавливания прыщей;
- Избегайте ношение тапочек в общественных душах и бассейнах;
- Ношение перчаток при контакте с инфицированными людьми.
Введение
Два разных типа микроорганизмов присутствуют на коже и придатках. Один из них состоит из резидентных микроорганизмов или комменсалов, которые, в большинстве случаев, являются безвредными и непатогенными, а иногда и полезны для хозяина. Вторая группа состоит из транзиторных микроорганизмов, которые могут оказывать вредное и патогенное воздействие и колонизируют кожу после травмы, что приведет к воспалению и развитию инфекции кожи [1–3].
Благодаря доступности биоинформационных технологий, ведущих к обнаружению новых филогенетических подходов, в последние годы было сделано много открытий. Проведены исследования по изучению разнообразия и топологии микробиотеы кожи, по выявлению различных комменсальных микроорганизмов, присутствующих на коже. Это позволило оценить относительную численность каждой популяции, и понять их полезную роль или вклад в дерматологические состояния, такие как акне[4–6].
Метагеномный анализ и секвенирование рибосом 16S РНК гена являются преобладающими бактериологическими методами для анализа бактериального состава микробных сообществ и для выбора наиболее эффективного дизайна исследования, имеющее решающее значение для получения значимых результатов анализа [7].
Так, физиологические характеристики различных участков кожи ассоциировались с различным уровнем бактериального разнообразия, включая Actinobacteria такие как Propionibacteria, совсем недавно переименованная в Cutibacteria (включая Cutibacterium acnes, а также Cutibacterium granulosum и Cutibacterium avidum), Proteobacteria, Bacteroides и Firmicutes; Staphylococcus epidermidis относится к последней группе [5, 6, 8, 9].
Из них C. acnes и S. epidermidis являются двумя основными комменсальными кожными бактериями [3, 10–12].
До недавнего времени исследования в области акне были в основном сосредоточены на роли C. acnes, тогда как роль S. epidermidis обсуждалась в течение нескольких лет, но ее еще предстоит выяснить [10, 13].
Целью настоящей статьи является обзор опубликованных данных о роли S. epidermidis в физиопатологии акне и представление будущих перспектив лечения на основании имеющихся данных и доказательств.
Методы
Был произведен обзор литературы, опубликованной между началом 2000 и 2022 гг. и доступная в PubMed, с использованием следующих ключевых слов: акне, вульгарное акне + микробиота, кожа + микробиота, акне + микробиота + Propionibacteria acnes+ Staphylococcus epidermidis, бактериальная устойчивость, кожные комменсалы + Propionibacterium acnes + Staphylococcus epidermidis.
Результаты
Взаимодействие кожи хозяина и кожной микробиоты
Взаимодействие кожи хозяина и микробиоты в иммунной системе кожи позволяет дифференцировать безвредные комменсальные микроорганизмы, такие как Corynebacterium sp., Staphylococcus sp. , исключая S. aureus, Cutibacterium sp., Malassezia furfur , и транзиторные, вредные, патогенные микроорганизмы, такие как S. aureus, Streptococcus pyogenes и Enterobacteriaceae. Даже при том, что распознавание идет с участием иммунной системы человека, этот механизм не полностью понят. Сообщалось, что Toll-подобные рецепторы (TLR) десенсибилизируются в результате длительного воздействия комменсальных микроорганизмов, либо за счет снижения их экспрессии на поверхности клетки через активацию ингибиторов пути TLR киназы 3 [14, 15].
Более того, специфичность может быть достигнута путем совместного распознавания патоген-ассоциированных молекул через их рецепторы распознавания [6].
Таким образом, оба таких признанных комменсала C. acnes и S. Epidermidis взаимодействуют с хозяином, помогая защитить здоровую кожу от колонизации патогенами [9, 16].
Рис. 1. Здоровая кожа и кожа с акне. а. Здоровая кожа. В здоровой коже S. epidermidis контролирует пролиферацию C. acnes. b Образование микрокомедона после чрезмерной колонизации кожи C. acnes, приводящей к дисбиозу. Чрезмерная колонизация C. acnes в период полового созревания приводит к дисбактериозу и угревой болезни. AMP, антимикробные пептиды; TLR, Toll-подобные рецепторы; PAR, протеазоактивированные рецепторы.
Однако состав кожной микробиоты постоянно развивается и меняется со временем. Например, нарушение баланса или дисбактериоз ранее здоровой кожи, вызванный внешними факторами, такими как травма, стресс или загрязнение, или эндогенными факторами (гормональные изменения, изменения pH), может вызывать воспалительные заболевания кожи, такие как акне, атопический дерматит, розацеа и псориаз [13, 17–21].
В частности, в период полового созревания увеличивается продукция кожного сала и происходит его качественное изменение за счет гормональных модификаций , что может привести к развитию несбалансированной микробиоты кожи через усиленную колонизацию пилосебацейного комплекса и поверхности кожи C. acnes [6].
Это чрезмерное размножение может быть связано с доступностью питательных веществ [22].
Роль C. acnes
В здоровой коже C. acnes играет полезную роль в микробиоте пилосебацейного комплекса. Он ограничивает рост S. aureus, метициллин-устойчивых штаммов S. aureus, а также S. pyogenes при поддержании кислого рН в пилосебацейном комплексе путем гидролиза триглицеридов кожного сала и секреции пропионовой кислоты [6, 23, 24].
Тем не менее, в период полового созревания чрезмерная колонизация пилосебацейного комплекса C. acnes может привести к потере разнообразия и дисбиозу, что приводит к развитию акне [6, 25–27].
Недавнее клиническое исследование, в котором использовался метод типирования на основе однолокусной последовательности, изучало подгруппы C. Acnes на лице и спине у пациентов с тяжелым акне и у здоровых людей [28].
Почти у 75% пациентов с угревой сыпью филотипы C. acnes были идентичны на лице и спине, тогда как это было только у 45% здоровых людей. В здоровой группе филотипы IA1 (39%) и II (43%) были основными филотипами, тогда как в группе акне филотип IA1 (84%), особенно на спине (96%), был основным. Это может подтвердить гипотезу о том, что тяжесть акне может быть связана с потерей разнообразия филотипов C. acnes и выбора основного филотипа IA1 среди пациентов с акне [28–30].
Следовательно, различные воспалительные профили зависят от филотипа (то есть филотипа IA1, который в основном наблюдается на лице и спине пациентов с акне), который активирует врожденный иммунитет посредством экспрессии протеазоактивируемых рецепторов (PAR), фактора некроза опухоли-α и интерферон-γ и интерлейкинов (ИЛ-8) [28, 31–37].
Кроме того, C. acnes активирует высвобождение липаз, матриксных металлопротеиназ и гиалуронидаз, приводя к гиперкератинизации пилосебационной единицы и, наконец, к комедонам, папулам и пустулам [31–34, 38].
На рис. 1 показана разница между здоровым микробиомом и микробиомом с дисбиозом.
Роль S. epidermidis
S. epidermidis – это наиболее часто выделяемый из эпителия комменсальный вид [25, 39].
Он колонизирует преимущественно подмышечные впадины, голову, носовые ходы и обычно непатогенен для человека[11, 39].
S. epidermidis относится к группе коагулазонегативных стафилококков, которые отличаются от коагулазопозитивных стафилококков, таких как S. aureus, отсутствием фермента коагулазы. Согласно типированию на основе мультилокусных последовательностей существует большое разнообразие S. epidermidis , более чем 400 идентифицированных типов (STs), по сравнению со 155 для C. acnes [40, 41].
Большинство клинических изолятов относятся к CC2, из которых часто выделяется ST2. Возможно, успешное распространение ST2 может быть связано с тем, что все изоляты ST2 содержат IS256 последовательность и гены ica – эти два фактора коррелируют с инвазивностью S. epidermidis [42, 43].
Тем не менее, до сих пор существует спор о том, является ли icaA полезным маркером биопленки S. epidermidis [44].
В прошлом S. epidermidis считался безвредным комменсальным микроорганизмом на коже человека. В настоящее время он рассматривается как важный оппортунистический патоген. Он является наиболее частой причиной внутрибольничных инфекций, как и его более вирулентный кузен — S. aureus. В частности, S. epidermidis представляет собой наиболее распространенный источник инфекции на стационарных медицинских устройствах [45].
Лечение осложняется специфическими антибиотикорезистентными генами и образованием биопленок, многоклеточных агломераций, которые обладают внутренней устойчивостью и толерантностью к антибиотикам и механизмам защиты хозяина [46].
Кроме того, исследования выявили специфические молекулярные детерминанты, позволяющие иммунную инвазию S. epidermidis и способность вызывать хронические заболевания [47].
Предполагается, что S. epidermidis имеет свои, оригинальные функции для неинфекционного образа жизни, подчеркивая случайную природу инфекций S. epidermidis, что позволяет проводить различие между носительством, заражением и инфекцией. Лучшее понимание физиологии S. epidermidis важно для оценки терапевтических стратегий против инфекций S. epidermidis [39].
Некоторые штаммы S. epidermidis могут модулировать врожденный иммунный ответ хозяина, особенно TLR 2, и, таким образом, позволяют хозяину бороться с патогенами [6, 28].
Было показано, что фенорастворимые модулины, продуцируемые S. epidermidis, избирательно ингибируют кожные патогены, такие как S. aureus и Streptococcus группы A, и вместе с антимикробными пептидами хозяина(AMP) усиливают их элиминацию [48–50].
Кроме того, S. epidermidis активирует экспрессию AMP кератиноцитов через TLR2-зависимый механизм [51].
Это подтверждает, что этот комменсал тесно взаимодействует с врожденным иммунитетом хозяина [48, 49].
Это также было показано через микродиссекцию эпидермиса, дермы, жировой ткани с последующим секвенированием 16S рибосомальной РНК, демонстрирующим, что колонизация S. epidermidis регулирует перемещение Т-клеток и их функции через IL-1 [52, 53].
В другой недавней исследовательской работе сообщалось, что S. epidermidis может также защищать от новообразований кожи путем производства 6-N-гидроксиаминопурина, молекулы, которая ингибирует активность ДНК-полимеразы [54].
Кроме того, масляная кислота, выделяемая S. epidermidis, позволяет стволовым клеткам жировой ткани дифференцироваться в адипоциты и накапливать липиды в цитоплазме, что приводит к увеличению дермального слоя [55].
Взаимодействие между S. epidermidis и C. acnes при акне
S. epidermidis и C. acnes используют глицерин в качестве общего источника углерода для производства различных короткоцепочечных жирных кислот (SCFA), используемых в качестве противомикробных средств для конкуренции друг с другом. Эти два микроорганизма играют роль в патогенезе и развитии акне. [56, 57].
Пока нет никаких доказательств того, что S. epidermidis играет активную роль в патогенезе акне,но преимущественно C. acnes в настоящее время ассоциируется с угрями [9].
Было показано, что некоторые изоляты S. epidermidis ,с помощью анализа антагонизма,обладают противомикробной активностью в отношении C. acnes [27, 56].
Среди штаммов S. epidermidis с повышенной антимикробной активностью наблюдались различия в диаметре ингибиторных зон, что указывает на то, что антимикробные вещества имели различную природу. Большинство штаммов S. epidermidis имели небольшие зоны ингибирования (2–4 мм) против C. acnes, а некоторые штаммы создавали светонепроницаемые зоны ингибирования. Один штамм, FS1 продуцировал очень большие ингибирующие зоны (> 10 мм), но не был активен против всех протестированных штаммов C. acnes. Другой штамм, 14.1.R1, ингибировал все штаммы C. acnes, но продуцировал только небольшие зоны ингибирования (2–5 мм). Не было отмечено различий в противомикробной активности штаммов S. epidermidis, выделенных из нормальной и кожи с акне, соответственно. Аналогичным образом, происхождение штаммов C. acnes не определяло их восприимчивость к антимикробной активности S. epidermidis, поскольку штаммы, выделенные из очагов угревой сыпи и здоровой кожи существенно не отличались по характеру восприимчивости к S. epidermidis. Наоборот, исследование показало более высокую антимикробную активность среди C. Acnes филогруппы I-2, против S. epidermidis. Авторы выдвинули гипотезу о возможном наличии и секреции бактериоцина или бактериоцино подобного вещества, специфичного для филогруппы I-2 C. acnes [13].
Зависимость степени тяжести акне(легкая, умеренная или тяжелая ) от антимикробной активности варьировала от 29 до 39%. Следовательно, штаммы C. acnes типа IA1 CC18, в основном участвующие в акне, не проявляли более высокой антимикробной активности по сравнению со здоровыми штаммами.
Различные исследования антагонизма показали, что in vivo S. epidermidis контролирует пролиферацию C. acnes посредством высвобождения янтарной кислоты, продукта ферментации жирных кислот, который ингибирует поверхностные TLR кератиноцитов , фактор некроза опухоли и IL-6, опосредованный C. acnes [27, 56, 58].
Так как на коже присутствуют как С. acnes, так и S. epidermidis, подавление воспаления, вызванного С. Acnes, может зависеть от активации на кератиноцитах стафилококком LTA miR-143 пути, необходимого для снижения воспалительной реакции. Исследования показали, что механизм LTA-miR-143-опосредованной супрессии передачи сигналов TLR2 осуществляется с помощью miR-143, нацеленного на 3’UTR TLR2. Тем самым уменьшается количество белка TLR2, и уменьшается воспаление, вызванного С. acnes [58–60].
Таким образом, он помогает регулировать гомеостаз кожи и подавлять воспаление, вызыванное C. acnes [58, 61].
Соответственно, несбалансированное равновесие между C. acnes и S. epidermidis в пилосебациальных единицах пациентов с акне в пользу филотипа IA1 CC18 C. acnes (75–80 случаев) может не позволить S. epidermidis в полной мере играть свою роль в качестве регулятора естественного кожного гомеостаза и ограничении роста C. acnes. На рисунке 2 визуально показано взаимодействие между C. acnes и S. epidermidis.
Рисунок 2. Бактериальные взаимодействия на коже. AMP, антимикробные пептиды.
S. epidermidis и его значение в выборе текущих и будущих методов лечения акне
Современное местное лечение акне включает в себя различные ретиноиды, такие как адапален и третиноин, которые уменьшают воспаление путем изменения врожденного иммунитета, активируемого C. acnes [62–65].
Помимо бензоилпероксида, применение антибактериальных средств, таких как эритромицин и клиндамицин, в монотерапии привело к развитию устойчивых к антибиотикам штаммов не только C. acnes, но и S. epidermidis в течение 4–6 недель [30, 57, 66].
Системные антибиотики, как сообщается, вызывают лишь небольшую резистентность, но могут привести к побочным эффектам в микробиоте кишечника [30, 33, 67].
Пероральный изотретиноин нормализует реакцию врожденной иммунной системы на C. acnes путем ингибирование ее пролиферации [68].
Таким образом, устранение только С. acnes может способствовать пролиферации S. aureus, вызывая воспаление кожи и полиферацию S. epidermidis, приводя к другому несбалансированному гомеостазу кожи и риску нозокомиальных инфекций.
AMP являются эффекторными молекулами врожденной иммунной системы кожи. Они являются амфипатическими (одновременно липофильные и липофобные) и разрушают липидную мембрану бактерии, приводя к лизису и гибели клеток, взаимодействуя преимущественно с отрицательно заряженными бактериальными мембранами, а не с нейтрально заряженными мембранами клеток млекопитающих. Важность вклада AMP в иммунитет человека неоспорим, поскольку изменения в экспрессии AMP связаны с различными патологическими процессами. Тем не менее, данные о роли AMP в обыкновенных угрях ограничены. Недавно опубликованное исследование сообщает, что AMPs hBD-1 и кателицидины играют важную роль в патогенезе угрей [69].
AMP показали активность против широкого спектра грамположительных и грамотрицательных бактерий, а также некоторых грибов, паразитов и вирусов с оболочкой [70].
Они производятся как ответ кератиноцитов и себоцитов. Однако они также способствуют развитию дополнительных воспалительных реакциий. Продукция AMP включает в себя β-дефензины, РНКазу 7, белок псориазин S100 и кателицидины и опосредуется путем MyD88 и передачей сигналов IL-1. Кроме того, было продемонстрировано, что все больше клеток экспрессируют TLR-2 по мере увеличения тяжести акне[33].
Это может быть одним из объяснений того, почему средства, нацеленные на TLR-2, такие как местные ретиноиды, обладают большей эффективностью у пациентов с более тяжелой степенью акне [71].
Цитокины также продуцируются в результате взаимодействия между C. acnes и TLR-2, дефензинами и матриксной металлопротеиназой посредством активации PAR-2R [72].
Другим подходом к лечению может быть регулярное пероральное или местное добавление в микробиоту кожи полезных микроорганизмов (пробиотиков) для пациентов с угревой сыпью для уравновешивания микробиоты кожи [73, 74].
В 2010 году Arck et al. [75] предположили, что существует не только ось кишечник – мозг или кожа — мозга, но и ось кишечник — кожа. Авторы показали, что пероральные добавки штамма Lactobacillus у мышей ослабляют, вызванное стрессом ,нейрогенное воспаление кожи и тормозят выпадение волос. Их концепция предполагала, что модуляция микробиоты путем применения пробиотиков уменьшает нейрогенное воспаление кожи. Эти наблюдения вселяют надежду, что правильный вид бактерий может оказывать благотворное влияние на гомеостаз кожи, воспаление и реакцию периферических тканей на воспринимаемый стресс. Другие исследования, проведенные на людях, подтвердили эту гипотезу [76–78].
Таким образом, пробиотики могут быть эффективны при акне и других воспалительных заболеваниях кожи, таких как атопический дерматит и ,возможно, при псориазе [79–83].
С этой точки зрения, исследования показывают, что S. epidermidis может контролировать дисбактериоз, вызванный C. Acnes и уменьшать тяжесть акне [27, 56].
Однако до сих пор остается неясным, какой SCFA в продуктах ферментации глицерина S. epidermidis в первую очередь способствует анти-С. acnes эффект. Также не определено, действуют ли SCFA вместе с другими антимикробными молекулами в продуктах ферментации, чтобы оказать анти-С. acnes эффект. Анти-С. acnes эффект ферментированной среды сохранялась после кипячения указанной среды, что позволяет предположить, что антимикробные белки / пептиды могут не вносить основной вклад в анти-С. acnes эффект ферментированных сред [56].
Пролекарства, такие как пивалоилметилбутират SCFA (AN-9), были разработаны для достижения фармакологических концентраций таких SCFA in vivo [84].
Более того, живой S. epidermidis потенциально может быть использован в качестве активного компонента в пробиотиках для акне[27, 56].
Обсуждение и вывод
Акне — это хроническое и многофакторное воспалительное заболевание кожи и пилосебацейной единицы. Дисбиоз у пациентов с угревой юолезнью связан с уменьшением количества S. epidermidis и чрезмерной колонизацией определенными филотипами C. acnes в пилосебацейной единице, что приводит к различным уровням активации врожденного иммунитета и к разной степени тяжести акне. Недавние исследования, по-видимому, подтверждают полезную роль S. epidermidis в физиопатологии угрей посредством ограничения колонизации кожи C. acnes и воспаления [9, 33].
Однако нарушение равновесия в пользу S. epidermidis может также привести к другим последствиям для здоровья, таким как внутрибольничные инфекции. Следовательно, сбалансированный гомеостаз кожи должен быть конечной целью любого лечения акне.
В этом ракурсе можно рассмотреть другие варианты лечения, такие как пробиотики, полученные из S. epidermidis, позволяющие восстановить естественную, сбалансированную микробиоту, и регуляция медиаторов AMP хозяина без увеличения местной популяции S. Epidermidis эпидермиса.
Кто находится под угрозой заражения стафилококком и прыщей?
- Особыми рисками подвержены медсестры, врачи, пациенты с диабетом и пациенты с гемодиализом;
- Новорожденные;
- Женщины, которые кормят грудью;
- Люди с ожирением;
- Люди, живущие в переполненных сообществах или в жарком климате;
- Гимнасты, которые делят снаряжение для упражнений, люди, посещающие тренажерный зал;
- Лица с кожными травмами, хирургическими ранами, пирсингом и свежими татуировками;
- Лица с атопическим дерматитом или себореей, нарушенной иммунной системой, раком, диабетом, заболеваниями крови или легких, в том числе с лечением стероидами или химиотерапией
- Особо большим рискам подвержены люди, склонные к появлению и быстрому развитию прыщей, которые могут перейти в более тяжелую форму акне под влиянием стафилококка.
Как быстро убрать и снять воспаление прыща за ночь на лице и теле?
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
Рисунок 4. Кластер генов, биосинтетический путь и химическая структура лугдунина. а — Гены «субъединиц» (не модулей!) нерибосомной пептидсинтетазы S. lugdunensis: lugA, B, C и D. б — Функциональные домены продуктов оперона: А — аденилирующий, Р — пептидильный, С — конденсирующий, Е — эпимеризующий, R — редуктазный. Их специфические комбинации составляют модули — обособленные каталитические единицы фермента. Биосинтез лугдунина начинается, видимо, в инициирующем модуле LugD и продолжается последовательно с помощью LugA-C. в — Структурная формула лугдунина.
[1]
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Нерибосомные пептиды
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Строение
Нерибосомные пептиды имеют длину от 2 до 50 аминокислот и часто циклическую или разветвленную структуру. Они содержат как «обычные», протеиногенные, так и непротеиногенные аминокислоты — D-формы или остатки, модифицированные присоединением N-метильных и N-формильных групп, гликозилированием, гидроксилированием, ацилированием или галогенированием. Циклизация происходит путем образования в пептидном остове оксазолинов и тиазолинов [12].
Синтез
НРП синтезируются нерибосомными пептидсинтетазами (НРПС), которые в своей работе не следуют «чужим» инструкциям, то есть обходятся без мРНК. НРПС — это гигантские мультимодульные ферменты, каждый из которых может синтезировать только один вид пептидов. Отдельный модуль фермента отвечает за включение одной аминокислоты в пептидную цепь, поэтому количество модулей соответствует длине пептида [14].
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл−1, что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
Таблица 1. Спектр активности лугдунина
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл−1) |
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Кто подвержен риску заражения стафилококком?
Любой человек может развить инфекцию стафилококка, хотя некоторые группы людей подвергаются большему риску, включая новорожденных, женщин, кормящих грудью, и людей с хроническими заболеваниями, такими как диабет, рак, сосудистые заболевания и заболевания легких У потребителей инъекционных наркотиков, у которых присутствуют кожные травмы или расстройства, внутривенные катетеры, хирургические разрезы и у людей с ослабленной иммунной системой, вызванной либо заболеванием, либо являющейся результатом иммунопревращающих препаратов, все они имеют повышенный риск развития стафилококковых инфекций.
Некоторые группы людей подвергаются большему риску заражения стафилококками, например новорожденные, диабетики, потребители инъекционных наркотиков и пациенты с хирургическими разрезами.
О заболевании
Стафилококковая инфекция объединяет ряд заболеваний, которые могут проявляться гнойным поражением кожного покрова ребенка, патологией пищеварительного тракта, вовлечением в процесс ЛОР-органов или даже костей.
Важно учитывать, что выраженность клинической картины и опасность патологии для пациента напрямую зависит от разновидности стафилококка, который вызвал воспаление. Болезнь развивается спорадически (несистематично). Риск инфицирования во многом зависит от иммунной защиты малыша. Традиционно наблюдается повышение количества эпизодов стафилококковой инфекции у новорожденных детей. Это обусловлено недостаточной секрецией природного фактора IgA, который отвечает за защиту слизистых оболочек во всем теле человека.
Наиболее распространенными вариантами стафилококкового поражения организма являются:
- расстройство пищеварения, вызванное стафилококком;
- септицемия (распространение бактерии в крови);
- стафилококковый тонзиллит (ангина);
- остеомиелит.
Специалисты клиники «СМ-Доктор» имеют многолетний опыт успешного лечения детей любого возраста, столкнувшихся с заболеваниями, вызванными стафилококком.
Является ли прыщи стафилококка инфекционным заболеванием?
Инфекции Staph являются заразительными до тех пор, пока инфекция не разрешится Прямой контакт с инфицированной болью или раной или с помощью предметов личной гигиены, таких как бритвы, бинты и т д., являются общими путями передачи инфекции Случайные контакты, такие как поцелуи или обнимания, не представляют большой опасности для передачи, если нет прямого контакта с зараженной областью.
Некоторые виды инфекции стафилококка (см ниже) включают стафилококки, которые вызывают пищевое отравление или синдром токсического шока Эти специфические бактерии стафилококка вызывают заболевание, продуцируя токсин Токсин не является заразным, однако пищевое отравление может повлиять на группы людей, которые едят одну и ту же зараженную пищу.