Многоформная экссудативная эритема, клинические, иммунологические и терапевтические особенности
Многоформная экссудативная эритема (МЭЭ) — острое, нередко рецидивирующее заболевание кожи и слизистых (О. Л. Иванов, 1997). Этиологические факторы МЭЭ разнообразны. У пациентов с этим диагнозом имеется пусковой фактор, «включающий» механизм иммунной реакции гиперчувствительности. Пусковые факторы делят на две группы: аллергены медикаментозной, пищевой и т. д. природы, вызывающие токсико-аллергическую разновидность дерматоза, и инфекционные — вирусы, бактерии, простейшие, которые становятся причиной инфекционно-аллергической формы МЭЭ.
Клинические проявления заболевания
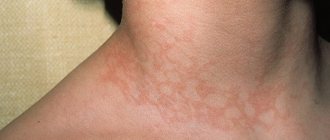
Картина заболевания включает характерную, чаще папулезную сыпь, приобретающую в процессе эволюции за счет центробежного увеличения элементов и разрешения с или «двухцветных пятен». При появлении элементы имеют в диаметре 2-3 мм и за один-два дня (иногда быстрее или медленнее), увеличиваются до 1—3 см, реже до большего размера. Название «многоформная» оправдано тем, что у пациентов в том или ином количестве могут присутствовать пятна, пустулы, пузыри, реже встречаются элементы по типу «пальпируемой пурпуры» (в нашей практике мы наблюдали двух таких пациентов, у них геморрагии присутствовали наряду с типичными элементами).
В случае мономорфной пузырной сыпи, при отсутствии или малом количестве типичных «мишеней», диагноз МЭЭ может вызывать затруднения. У 54-летней пациентки мы наблюдали мономорфную пузырную сыпь, представленную шестью крупными (до 7 см в диаметре) слабонапряженными пузырями на боковых поверхностях туловища. Общее состояние не было нарушено, акантолиза и эозинофилии в местах высыпаний не отмечалось. В анамнезе было уже несколько таких обострений, появлению пузырей предшествовали боли на месте давнего рубца в поясничной области, оставшегося после опоясывающего герпеса. МЭЭ диагностировалась на фоне реактивации вируса варицелла-зостер. Прием ацикловира позволил купировать проявления заболевания. В дальнейшем пациентка сообщила, что постоянно принимает ацикловир, и сыпь ее больше не беспокоит.
Локализация сыпи при МЭЭ — лицо, слизистые, разгибательная поверхность конечностей, тыльные стороны кистей и стоп, ладони, подошвы, туловище. В ряде работ указывается, что МЭЭ не поражает волосистую часть головы, однако мы наблюдали у одной из пациенток наряду с типичной папулезной сыпью пузыри, локализовавшиеся в том числе и на волосистой части головы. В теменной и затылочной области имелись четыре элемента, на момент осмотра покрытых корочками. В дальнейшем при снятии корок были видны эпителизировавшиеся правильной формы круглые эрозии диаметром 0,8-1,5 см. Расположение сыпи всегда симметричное.
При разнообразии «палитры» цвета элементов у разных больных почти всегда наблюдается розовый или фиолетовый оттенок, вероятно, связанный с преобладанием лимфоцитов. В качестве аналога можно привести красный плоский лишай, для которого характерен сиреневый цвет высыпаний и в гистологической картине в основном лимфоидный инфильтрат в дерме, вплотную примыкающий к эпидермису. Мы консультировали пациентку с периодически рецидивирующей и не исчезающей в течение двух-трех недель мономорфной папулезной сыпью в области локтей, элементы не сливались, имели розоватый оттенок, правильную уплощенную форму. Типичные «мишени» отсутствовали, однако розовый оттенок элементов, а также тип протекания дерматоза позволили поставить диагноз МЭЭ. При опросе выяснилось, что рецидивы развиваются через одну неделю после лабиального герпеса. Соответственно пациенткам поставили диагноз герпес-ассоциированной экссудативной эритемы.
Течение МЭЭ острое, наблюдается склонность к рецидивированию с той или иной частотой. Редко рецидивирующие формы проходят без лечения или после лечебных мероприятий, проводящихся в минимальном объеме. Мы консультировали пациента, у которого обострения МЭЭ имели сезонный характер и были приурочены к весенней и осенней институтской сессии. При сборе анамнеза пациент рассказал, что сыпь появляется в полном объеме в течение нескольких дней, потом начинает постепенно регрессировать. Время от времени он применял топические стероиды, что несколько ускоряло регресс сыпи. У большинства же наших пациентов МЭЭ рецидивировала часто или перманентно существовала в виде небольшого количества (до 5% поверхности тела без поражения слизистых) не доставляющих субъективных ощущений высыпаний; старые элементы регрессировали и постоянно появлялись новые. Например, у 60-летней пациентки постоянно присутствовали пять-шесть элементов по типу «мишени» в области тыла кистей и предплечий, старые регрессировали, оставляя стойкую гиперпигментацию, появлялись медленно увеличивающиеся новые. Никаких субъективных ощущений не было, однако локализация на открытых участках тела вызывала постоянный психологический дискомфорт. В другом случае у 30-летнего мужчины частота обострений постоянно нарастала и увеличивался объем высыпаний. В среднем через месяц после терапии в стационаре развивалось новое обострение. У этих, а также у других пациентов с частым рецидивированием дерматоза спонтанного регресса сыпи не отмечалось.
Патогенетические и иммунологические аспекты
Многоформная экссудативная эритема относится к заболеваниям, которые имеют характерные клинические проявления, но при этом вызываются разными причинами (об их составе речь пойдет ниже). Постоянная симптоматика, характерная для этого дерматоза, является естественным следствием единства патогенетических механизмов, которые на определенном этапе протекают одинаково при всех формах МЭЭ. Каков их морфологический субстрат? Он описывается в основном как лимфоцитарный инфильтрат вокруг сосудов, с небольшой примесью эозинофилов или нейтрофилов. Этот быстро накапливающийся инфильтрат имеет вид сине-розовых папул. В базальном слое наблюдается внутри- и внеклеточный отек, эпидермис может отслоиться с образованием пузыря, покрышку которого образуют все слои эпидермиса; соответственно, покрышка может сохраняться один-два дня неповрежденной, даже под одеждой или при большом диаметре пузыря. Могут встречаться экстравазаты, внешне проявляющиеся геморрагическими элементами. В целом, так как клиника МЭЭ достаточно типична, потребность в биопсии возникает редко. Патогистологическое исследование может оказаться серьезным подспорьем в диагностике, если клиническая картина МЭЭ представлена в основном пузырями. Мазки-отпечатки позволяют исключить акантолиз и, соответственно, пузырчатку, а малое число эозинофилов в пузырной жидкости снижает вероятность наличия герпетиформного дерматита и буллезного пемфигоида.
С позиции аллергологии МЭЭ представляет собой смешанную реакцию, имеющую черты гиперчувствительности как немедленного (ГНТ), так и замедленного (ГЗТ) типа. Черты ГНТ при МЭЭ: повышение общего IgE (реагиновые антитела) практически у всех пациентов и преобладание среди Т-хелперов клеток Th2 типа (19), наличие в инфильтрате CD8+ цитотоксических лимфоцитов (3,9), что роднит ее с аллергическим контактным дерматитом. Симптомы иммунокомплексной патологии при МЭЭ: отложение IgM и С3-компонента комплемента в местах высыпаний МЭЭ и обнаружение в крови ИК с вирусом простого герпеса, одного из триггеров МЭЭ [12, 17]. Тот факт, что МЭЭ не удается уложить в «прокрустово ложе» одной из классических аллергических реакций, классификация которых создана еще в 1969 г., во многом объясняется постоянным появлением новых данных, позволяющих разделить аллергию на все большее число типов. Механизм развития МЭЭ заслуживает детального изучения, мы рассмотрим его ниже на примере герпесассоциированной экссудативной эритемы.
В заключение вышеуказанного можно отметить, что в любом случае МЭЭ — это проявление сдвига адаптивных механизмов иммунного ответа в сторону гиперчувствительности, т. е. представляет собой аллергическую реакцию — вне зависимости от причинного фактора.
Предрасположенность и триггерные факторы развития МЭЭ
Для развития экссудативной эритемы у пациента должна иметь место гиперчувствительность, что объективно находит выражение в практически тотальном повышении у пациентов IgЕ. В случае МЭЭ, развившейся в результате введения медикаментов, процесс идет по типу токсидермии, соответственно строгое разграничение диагноза «токсидермия» и «токсико-аллергическая форма МЭЭ» не имеет смысла и не влияет на объем и состав проводимой терапии, которая определяется в основном тяжестью клинических проявлений. Выявить аллергию на медикаменты легче, чем другие типы аллергических реакций. Но при общей атопической предрасположенности организма реакция может возникать на пищевые или пыльцевые аллергены, тут взаимосвязь выявить труднее, поскольку она далеко не всегда осознается самим пациентом. Однако попытаться определить эту взаимосвязь стоит, поскольку это позволит сузить круг лечебных мероприятий (например, исключить антибиотики, которые, как правило, назначаются, если причины МЭЭ не установлены). В качестве примера можно привести такой случай. К врачу обратился молодой человек с множественными высыпаниями по типу «мишеней». Диагноз не вызвал затруднений, однако причина развития заболевания оставалась неясной. При сборе анамнеза выяснилось, что пациент имеет выраженный атопический фон, страдает бронхиальной астмой, в детстве дважды перенес отек Квинке, имеет место также пыльцевая и пищевая аллергия. В частности, после приема острой пищи всегда наблюдается кратковременное разжижение стула. Накануне появления сыпи пациент в ресторане попробовал новое очень острое блюдо. Соответственно в этом случае МЭЭ имеет токсико-аллергическую форму и требует мероприятий, направленных на элиминацию антигена. В целом токсико-аллергическая разновидность МЭЭ характеризуется клиническими и диагностическими особенностями, о которых будет сказано ниже. Удельный вес токсико-аллергической формы МЭЭ невелик, по разным данным, не превышает 20%. Не исключено, что такая низкая частота развития этой формы МЭЭ связана с тем, что подобный диагноз ставится, только если выявлен факт приема лекарств, в то время как, например, пищевая аллергия у взрослых часто проявляется в виде поражения кожи. Это еще раз свидетельствует о важности сбора анамнеза. При частом рецидивировании МЭЭ и невозможности выявления триггера, особенно при аллергических реакциях в анамнезе, можно рекомендовать ведение пищевого дневника с целью выявления пищевой аллергии.
Инфекционно-аллергическая форма дерматоза встречается чаще и создает больше терапевтических затруднений. Известно много бактериальных и вирусных агентов, которые провоцируют развитие МЭЭ. Как правило, это возбудители, которые формируют в организме очаг хронической персистенции с периодическими обострениями, что способствует сенсибилизации к инфекту. Роль бактериальной аллергии неоднократно находила объективные подтверждения в разного рода исследованиях [2, 13, 14, 15]. Локализация очага может быть любая. Наличие хронической инфекции в организме, уже являющееся следствием тех или иных дефектов иммунной системы, усугубляет их и может вызывать повреждение защитной противоинфекционной реакции, в том числе способствуя выработке медиаторов иммунного ответа, среди эффекторов которых есть клоны клеток, формирующих реакции гиперчувствительности. У наблюдавшихся у нас пациентов мы находили очаги инфекции чаще в области носоглотки, придаточных пазух и дыхательной системы, реже она имела урогенитальную локализацию. Как правило, очаг инфекции не удается определить при первой беседе с пациентом, в большинстве случаев поиск инфекта требует осмотра смежными специалистами, а также лабораторно-инструментального обследования. Впервые развившаяся острая инфекция также может провоцировать МЭЭ, однако в этом случае это происходит спустя одну-две недели. В то же время МЭЭ на обострение хронического очага может проявляться в первые дни его активации.
Патология пищеварительного тракта, которую принято считать одной из причин развития МЭЭ, также не носила явного характера, у всех пациентов при опросе и обследовании выявлялись минимальные симптомы хронического колита, дискинезии желчевыводящих путей, чаще по гипомоторному типу, признаки хронического гастрита, дисбиоз кишечной микрофлоры первой-второй степени. Однако у всех пациентов был снижен уровень IgА, конечный этап синтеза которого происходит в кишечной стенке.
Толчком к развитию МЭЭ может служить стресс в широком смысле слова. У наблюдаемых нами пациентов в качестве «толчкового» фактора чаще выступало психологическое напряжение и переутомление на работе или учебе (различного рода проверки, сессия), реже — переохлаждение. У одной пациентки МЭЭ дебютировала после эмоционального стресса (смерть отца), еще у трех человек после гиперинсоляции. У обратившейся к нам молодой женщины МЭЭ развивалась после ортостатической нагрузки (длительная ходьба или стояние). Явное доминирование психологического напряжения в качестве триггера подчеркивает актуальность соблюдения у пациентов с рецидивирующей МЭЭ рационального режима труда и отдыха, как компонента профилактики обострений.
Таким образом, фоном для развития МЭЭ являются атопия, выражающаяся в повышении общего IgE, персистенция хронической инфекции в организме, снижение IgA, являющегося одним из представителей «первой линии обороны» кожи и, в большей степени, слизистых оболочек. Толчком к рецидиву МЭЭ часто служит стресс или переутомление.
Клинические особенности МЭЭ в зависимости от этиологического агента
| Рисунок 1 |
| Рисунок 2 |
| Рисунок 3 |
| Рисунок 4 |
| Рисунок 5 |
| Рисунок 6 |
При общих закономерностях локализации сыпи и характеристики элементов МЭЭ этиология заболевания обусловливает некоторые его особенности. Мы наблюдали 14 пациентов с инфекционно-аллергической формой МЭЭ (невирусного происхождения) и шестерых — с токсико-аллергической. Токсидермический вариант характеризовался большей распространенностью сыпи, поражением туловища и проксимальных отделов конечностей, вовлечением слизистых. Высыпания были представлены очагами отечной гиперемии, имели ярко-красный оттенок, диаметр до 10 см, тенденцию к группировке в крупные очаги неправильной формы. При этом по периферии крупных очагов обнаруживались мелкие, имеющие характерный для МЭЭ вид «мишени». Крупные фигуры, образующиеся в результате слияния, также начинали разрешаться с центра (см. рисунок 1). Иногда на фоне крупных пятен образуются мелкие внутриэпидермальные пузырьки, возникающие вследствие спонгиоза (см. рисунок 2). Если же высыпания токсико-аллергической МЭЭ имели ограниченный характер, то они были связаны с пероральным поступлением антигена и тяготели к локализации на слизистой рта и гениталий, что обусловлено путем поступления и элиминации антигена (см. рисунки 3, 4). Если поражались кисти рук, то в процесс чаще вовлекалась поверхность ладоней (см. рисунок 5), в то время как для инфекционно-аллергической МЭЭ в большей степени было характерно поражение тыльной стороны кистей (см. рисунок 6). (При рассмотрении типичного элемента, расположенного на тыле кисти, видно, что по периферии «мишени» расположены две мелкие папулы, которые в процессе центробежного распространения могут приобрести характерный вид.) В случае токсико-аллергической формы с сыпью по типу «мишеней» в центре элементов чаще развивались пузыри, т. е. «мишеневидность» была вызвана не разрешением с центра, а формированием в центре пузырей с прозрачным содержимым и плотноватой покрышкой. Наблюдалась изоморфная реакция в местах трения одежды или обуви, элементы тяготели к слиянию с формированием псевдооднокамерных пузырей неправильной формы. Однако общее состояние пациентов при этом сильно не страдало.
Инфекционно-аллергическая форма заболевания характеризовалась всеми возможными вариантами клинических проявлений МЭЭ. Тяжесть проявления зависела от степени сенсибилизации организма на антиген и фонового состояния противоинфекционного иммунитета. В целом можно отметить, что инфекционная форма МЭЭ характеризовалась меньшим диаметром очагов (до 2 см), более «застойным», синюшным оттенком высыпаний и стремлением к локализации на конечностях. Тенденции к слиянию мы не наблюдали. Кроме того, при инфекционно-аллергической форме реже поражалась слизистая гениталий, в отличие от токсико-аллергической формы.
Токсико-аллергическая форма МЭЭ характеризуется более яркой гиперемией, тенденцией к слиянию очагов, частым поражением слизистых, в том числе гениталий, более выраженным эпидермолитическим компонентом (пузыри), изоморфной реакцией. Инфекционно-аллергическая форма чаще проявляется небольшими элементами, более «застойного» оттенка, не имеющими тенденции к слиянию, тяготеющими к локализации на конечностях и реже поражающими слизистые.
Герпесассоциированная многоформная экссудативная эритема
По данным статистики, до 80% МЭЭ вызывается вирусом простого герпеса (ВПГ) [16], поэтому мы провели работу по оценке клинических и иммунологических параметров именно этой формы, как наиболее часто встречающейся в практике. Среди обратившихся к нам пациентов с МЭЭ 73% составила герпесассоциированная экссудативная эритема (ГАМЭЭ).
Следует отметить, что диагноз ГАМЭЭ мы ставили на базе клинических данных. Это были типичные проявления МЭЭ, развившиеся в сроки от 12 ч до 12 дней от начала рецидива простого герпеса (ПГ), имевшего клинически очевидную форму — сгруппированные везикулы на отечно-эритематозном фоне. Проявления ГАМЭЭ характеризовались в основном очагами небольшого размера — до 2,5 см в диаметре, и представлены были всем спектром возможных при МЭЭ элементов. Мономорфную сыпь мы наблюдали всего несколько раз: у двух человек папулезную сыпь, представленную одинаковыми розовыми уплощенными папулами диаметром 1-1,3 см, группировавшимися в локтевых областях у одной пациентки и на всей разгибательной поверхности рук, в небольшом количестве на ногах и туловище у второго пациента. У 54-летней женщины была выявлена буллезная форма — крупные пузыри диаметром от 2 до 7 см, располагавшиеся на боковой поверхности туловища. В основном сыпь при ГАМЭЭ была представлена уплощенными сине-розовыми папулами до 3 см в диаметре, которые разрешались с центра, в центре очагов в ряде случаев формировались пузыри с плотной покрышкой, встречались мелкие пустулы и единичные геморрагические очаги. Особенностью ГАМЭЭ явилось редкое вовлечение в патологический процесс области гениталий. Эволюционная динамика сыпи в целом не имела отличий от МЭЭ. Частота рецидивирования ГАМЭЭ была высокой, 5—12 раз в год, что, вероятно, обусловлено особенностями этиологического фактора — ПГ, при нарушениях противовирусного звена иммунитета, склонного к частому рецидивированию.
ГАМЭЭ склонна к частому рецидивированию, 5—12 раз в год, представлена, чаще всего, солитарными небольшими папулезными элементами по типу «мишени», распространенность сыпи варьирует. Гениталии редко вовлекаются в патологический процесс.
Иммунологические параметры ГАМЭЭ
Наряду с клиническими особенностями ГАМЭЭ, интерес представляют ее иммунологические параметры. Выявляемая иммунологически предрасположенность к ГАМЭЭ может в некоторой степени свидетельствовать о предрасположенности к развитию у пациентов с ПГ герпесассоциированных заболеваний. Ведь вирусная репликация может изменять генный аппарат как резидентных клеток, например эпидермоцитов (в этом случае это ведет к ограниченным эпидермисом поражениям), так и иммунокомпетентных клеток, тогда могут наблюдаться системные заболевания, например СКВ. Данное предположение свидетельствует о пользе активной терапии пациентов с соответствующими изменениями. Согласно этой же гипотезе меняться может как рецепторный аппарат клеток, так и ферментный или иммуномедиаторный (цитокиновый) профиль [7].
Для ГАМЭЭ характерны повышение IgE, снижение IgА, понижение числа NK-клеток и g-интерферона, резкое повышение спонтанной выработки ИЛ-4 и ИЛ-6 над индуцированной продукцией, которая истощена, снижение рецепторов к ИЛ-2.
ГАМЭЭ представляет собой смешанную реакцию гиперчувствительности с иммунокомплексным компонентом той или иной степени выраженности.
Терапия многоформной экссудативной эритемы
Лечение данного заболевания включает как купирование рецидива, так и профилактику дальнейших обострений. Следует учитывать, что экссудативная эритема представляет собой аллергическую реакцию, независимо от этиологического фактора. При выявлении триггера добавляются соответствующие мероприятия.
При купировании рецидива мы брали за основу тип протекания дерматоза. Если при первичном обращении пациент сообщает, что у него наблюдаются частые рецидивы и (или) обильные высыпания, имеются участки некроза в центре элементов, поражены слизистые, выражен эпидермолитический компонент, мы применяем однократную инъекцию 2 мл дипроспана (раствор для инъекций, включающий β-метазон в форме динатрия фосфата и диприпионата).
К назначению антибиотиков, на наш взгляд, следует прибегать только при присоединении вторичной инфекции в местах высыпаний или в том случае, если имеется явное указание на активный очаг инфекции. В большинстве случаев действия дипроспана вполне достаточно для купирования рецидива МЭЭ. Параллельно следует выявить триггер, если имеется подозрение на наличие очага хронической инфекции. Больной направляется на консультацию к отоларингологу, терапевту, урологу; у пациента берутся мазки для выявления ИППП. При сборе анамнеза у таких пациентов выявляются положительный эффект от приема антибиотиков без применения дипроспана, частые простудные заболевания. Если же клиника соответствует токсико-аллергическому варианту, в анамнезе есть указания на другие аллергические реакции, пищевую, пыльцевую аллергию. В этом случае следует дополнительно проводить мероприятия, направленные на скорейшую элиминацию антигена: энтеросорбенты в случае пищевой аллергии и т. д. В некоторых случаях можно обойтись без применения дипроспана. Речь идет о пациентах, у которых данное обострение не первое, проходит самостоятельно или с применением только местных средств — топических стероидов, различного рода полосканий для полости рта (ротокан, настой ромашки, облепиховое или шиповниковое масло и т. д.). В этом случае основной акцент следует сделать на выявлении триггера, а при невозможности его обнаружения и редком рецидивировании (один-два раза в год) можно ограничиться только купированием рецидивов с применением минимального объема терапевтических мероприятий. Необоснованное применение разных иммуномодуляторов при редком рецидивировании дерматоза также может нарушить «шаткое равновесие» и спровоцировать учащение обострений.
В целом, следует отметить, что дипроспан является оптимальным средством при необходимости купировать обострение. Недостаточность терапии глюкокортикостероидами на ранних этапах лекарственной аллергии может служить основной причиной развития в дальнейшем тяжелых токсидермий и синдрома Лайелла [6]; существуют указания на развитие синдрома Лайелла после абортивных атак МЭЭ [1]. Учитывая, что МЭЭ представляет собой аллергическую реакцию вне зависимости от триггера, очевидно, данное высказывание в некоторой степени справедливо и по отношению к другим ее формам. Мы не использовали дипроспан при наличии прямых противопоказаний к применению системных стероидов, а также при «мягком», самолимитирующемся течении дерматоза и в ряде случаев по индивидуальным показаниям. В частности, мы наблюдали пациента с распространенным поражением кожи (около 25% от всей поверхности) и слизистой рта, выраженным эпидермолитическим компонентом — в центре всех элементов сформированы пузыри. В анамнезе присутствовал атопический фон, в том числе бронхиальная астма, приступы которой пациент с успехом купировал инталом или фенотеролом. Токсико-аллергическая МЭЭ (на определенный вид пищи) развилась впервые, однако различные аллергические реакции, также купируемые с помощью интала, наблюдались и ранее. Общее состояние пациентов страдало в очень небольшой степени. Несмотря на показания к применению дипроспана, мы не стали его использовать, чтобы повлиять на течение бронхиальной астмы, не требующей на момент обращения использования стероидов. Терапия включала стабилизаторы мембран тучных клеток per os, энтеросорбцию и топические стероиды. В течение недели высыпания разрешились, прием интала был рекомендован в дальнейшем в качестве профилактических курсов, также больным назначалась гипоаллергенная диета, консультация аллерголога.
Лечение МЭЭ включает купирование рецидива, чаще с использованием дипроспана, без которого можно обойтись при самолимитирующемся течении дерматоза и воздействии на триггер, которое варьирует в зависимости от его природы.
Терапия ГАМЭЭ
Под нашим наблюдением находились 45 больных с ГАМЭЭ. Сначала мы назначали всем пациентам синтетические нуклеозиды, однако эффект наблюдался только у небольшого числа пациентов. У большинства же рано или поздно приходилось прибегать к назначению дипроспана. Проанализировав ситуацию, мы пришли к выводу, что нуклеозиды эффективны у тех пациентов, у которых простой герпес имеет на момент развития ГАМЭЭ активные проявления, т. е. находится в везикулезной стадии. Видимо, гиперчувствительность у этих пациентов развивается на высоте реплицирования вируса, и интерлейкины еще не успевают повлиять на весь спектр патологического действия. Соответственно, прервав репликацию вируса, мы блокируем дальнейшее развитие процесса, кроме того, активный вирусный процесс является противопоказанием для применения дипроспана (хотя появляется все больше сообщений о параллельном применении системных стероидов и нуклеозидов при ГАМЭЭ). У тех пациентов, организм которых восстановил контроль над ВПГ (крустозная стадия ПГ определяется клинически), адаптивный механизм уже выполнил свою функцию и перешел в фазу неконтролируемой гиперчувствительности. Этим пациентам показан дипроспан, а синтетические нуклеозиды целесообразно применять после купирования обострения, в целях профилактики. В целом ГАМЭЭ легче предупредить, чем лечить, неоднократно публиковались сообщения о том, что пролонгированный прием нуклеозидов эффективен для ее предупреждения. Остается добавить, что эти препараты нужно принимать именно по непрерывной схеме, поскольку срыв латентности вируса возвращает иммунную систему к исходному уровню.
В дальнейшем для профилактики ГАМЭЭ мы применяли герпетическую поливакцину: два курса по пять инъекций в дозе 0,1-0,2-0,3-0,3-0,3 с двухнедельным перерывом между курсами; ревакцинация проводилась через шесть месяцев, и через год — для закрепления результата. Ревакцинацию целесообразно осуществлять в случае, если первый курс оказался эффективным. Если же первая инъекция вызывает обострение процесса, вероятнее всего, она назначена слишком рано. Важно определить момент, когда целесообразно начинать вакцинацию. Мы рассматривали в качестве критерия нормализацию уровней спонтанной и индуцированной выработки ИЛ-4 и ИЛ-6. В ходе этого процесса, который может оказаться довольно длительным, мы назначали фамцикловир по 250 мг два раза в сутки, или валацикловир 500 мг два раза в сутки, либо ацикловир 200 мг четыре раза в сутки. Если при исходном тестировании иммунного статуса повышены уровни других цитокинов, участвующих в формировании воспалительной реакции, например ИЛ-1 или ФНО, для начала вакцинации необходима нормализация уровня их выработки, поскольку повышение данных показателей увеличивает риск поствакцинальных осложнений.
Эффективность вакцинации составила 71%, что заключалось в сокращении числа рецидивов ПГ и, соответственно, уменьшении ГАМЭЭ в два—четыре раза. У нескольких пациентов рецидивы отсутствовали в течение всего периода наблюдения (один год). В целом чем мягче протекает ГАМЭЭ, тем лучше прогноз при вакцинации, поскольку выраженное поражение кожи наблюдается при максимальном компоненте гиперчувствительности, и тем больше времени занимает нормализация цитокинового профиля. В заключение можно напомнить, что применение дипроспана и вакцинация имеют свои противопоказания, такие, как сахарный диабет, язвенная болезнь или глаукома (для дипроспана), поэтому необходим тщательный сбор анамнеза для их выявления. Вакцинация также должна проводиться с учетом всех требований безопасности лечения и при наличии средств для купирования поствакцинальных осложнений, сведения о которых можно найти в соответствующих руководствах по медицинской вакцинологии.
Литература
- Гусаренко Л. А. Случай синдрома Лайелла, развившийся вслед за абортивной атакой экссудативной эритемы. — Российский журнал кожных и венерических болезней, 1998. — №3. — С. 63-67.
- Байкова Р. А. Особенности клиники и лечения многоформной экссудативной эритемы // Дис. канд. — М., 1969.
- Белкин Б. Г., Санян Э. Ш. Вестник дерматологии, 1973. — №6. С. 61.
- Демьянов А. В., Котов А. Ю., Симбирцев А. С. Диагностическая ценность исследования уровней цитокинов в клинической практике. Цитокины и воспаление. — 2003. — Т. 2. — №3. — С. 20-35.
- Новиков Д. К., Сергеев Ю. В., Новиков П. Д. Лекарственная аллергия. — М., 2001.
- Новиков Д. К., Сергеев Ю. В., Новиков П. Д., Сергеев А. Ю. Побочные аллергические реакции на лекарства и медикаменты в дерматологии. Иммунопатология, аллергология, инфектология. — 2003. — №3. — С. 45-67.
- Новиков Д. К. Медицинская иммунология // Учебное пособие. — Витебск, 2002.
- Самгин М. Ф., Халдин А. А. Простой герпес. — Москва, 2002. — С. 160.
- Сигал Е. Я., Банах В. Р., Широкова Т. А. Акушерство и гинекология, 1975, №3. -С. 73-74.
- Соколов Е. И., Глан П. В., Гришина Т. И., Кузьменко Л. Г. и др. Клиническая иммунология // Руководство для врачей. — М.: Медицина, 1998.
- Ярилин А. А. Основы иммунологии //Учебник. М.: Медицина. 1999.
- Bushkell et all. J. invest. Derm. vol.74 p.372-374.
- Coltoin A., Mateescu D., Popescu S.et al. Derm-Vener. 1974. v.19, p.99-108.
- Eliaa P. M., Fritsh P., Mittermayer H. J.Invest. Derm.1976, v. 66, p.80-89.
- Epstein E., Flynn P., Davis R., J.A.M.A. 1974, v.229, p.425-427.
- Hwang Y.S., Spruance S.L. The epidemiologggy of uncommon herpes simplex virus type 1 infections. Herpes Journal,1999,vol.6(1),p.16-19.
- Leigh I.m. et al. Clin.exp. Derm.1985, vol. 10, p.58-67.
- Kats J., Livneh A., Shemer J., Danon Y. Herpes-simplex-virus-assotiated erythema multiforme-a clinical therapeutic dilemma.Pediatr-Dent .1999, 21(6)p.359-362
- Kokuba H., Imafuku S., Burnett J., Aurelian L., Longitudinal study of a patient with herpes-simplex-virus-assotiated erythema multiforme. Dermatology, 1999,198(3), р. 33-242.
О. Л. Иванов, доктор медицинских наук, профессор М. В. Халдина ММА им. И. М. Сеченова, Москва
Клиническая картина характеризуется острым началом. Заболевание часто начинается с продромальных явлений (повышение температуры тела, недомогание, боли в мышцах и суставах, боль в горле).
После продромального периода толчкообразно (в течение 10-15 суток и более) появляются полиморфные высыпания на коже — эритемы, папулы,пузырьки. В зависимости от выраженности клинических проявлений выделяют следующие формы болезни:
Легкая простая (папулезная) форма
Первичными морфологическими элементами являются гиперемические пятна (эритемы), папулы и пузырьки. Папулы округлой формы с четкими границами, величиной от 0,3 до 1,5 см, красно-синюшного цвета, плоские, плотные при пальпации, склонные к центробежному ростус западением центральной части.
По периферии папул образуется отечный валик, а центр элемента, постепенно западая, приобретает цианотичный оттенок (симптом «мишени», или «радужной оболочки», или «бычьего глаза».Характерны мишеневидные очаги менее 3 см в диаметре с четко очерченными краями, в структуре которых выделяют три различные зоны:
- центральный диск темной эритемы или пурпуры, который может стать некротическим или трансформироваться в плотную везикулу
- кольцо пальпируемого бледного отечного участка
- наружное кольцо эритемы.
Субъективно высыпания сопровождаются зудом. Патологические элементы склонны к слиянию с образованием гирлянд и дуг. Пузырьки округлой формы, небольшие, плоские, имеют толстую покрышку, наполнены опалесцирующей жидкостью, расположены, как правило, в центре папул.
Вторичными морфологическими элементами являются эрозии, корки, чешуйки, гиперпигментные пятна, не имеющие клинических особенностей.
Высыпания обычно появляются внезапно, располагаются чаще по периферии, симметрично на коже тыльной поверхности стоп и кистей, ладонях,разгибательных поверхностях предплечий и голеней, красной кайме губ с образованием корочек, слизистой оболочке полости рта, реже — на шее и туловище. Нередко избирательно поражаются только кисти.Поражение глаз и гениталий наблюдается реже.На слизистых оболочках могут образовываться пузыри, которые вскрываются с образованием болезненных эрозий.Разрешение высыпаний продолжается в течение 2-3 недель, не оставляя рубцов. Пигментные пятна, появляющиеся на месте бывших папул, отличаются желтовато-коричневой окраской.
Везикулобуллезная форма
Везикулобуллезная форма занимает промежуточное положение между папулезной и тяжелой буллезной формой. Очаги представлены эритематозными бляшками с пузырем в центре и кольцом пузырьков по периферии. Часто в процесс вовлечены слизистые оболочки.
Тяжелая буллезная форма
При тяжелой буллезной форме (синдроме Стивенса–Джонсона) начало острое, иногда с продромальными явлениями. Поражаются кожа, глаза, слизистые оболочки полости рта, половых органов, перианальная область; развиваются бронхиты, пневмонии. На слизистой оболочке полости рта возникают обширные пузыри с образованием эрозий, которые покрываются массивными геморрагическими корками. Характерно развитие катарального или гнойного конъюнктивита, на фоне которого иногда могут появляться пузырьки.
Нередко развиваются изъязвление роговицы, увеиты и панофтальмиты с потерей зрения. Поражение слизистых оболочек гениталий у мужчин приводит к нарушению мочеиспускания с возможным вовлечением в процесс мочевого пузыря. Отмечают пятнисто-папулезные высыпания или пузыри на коже, реже — пустулы, значительные по размерам и количеству. Период высыпаний составляет 2–4 нед. Кожный синдром сопровождается лихорадкой, пневмонией, нефритом, диареей, полиартритом и др. Иногда присоединяются паронихии и отит. Без лечения летальность при синдроме Стивенса–Джонсона достигает 5–15%. При всех вариантах многоформной экссудативной эритемы отмечается тенденция к рецидивам
Публикации в СМИ
Многоформная экссудативная эритема (мультиформная эритема) — остро развивающееся заболевание, характеризующееся появлением эритематозных пятен, буллёзным поражением кожи, слизистых оболочек, циклическим рецидивирующим течением.
Статистические данные. Заболеваемость — 0,3–0,5:100 000 населения, тяжёлые формы отмечают в 2–3 раза чаще у мужчин.
Классификация • Инфекционно-аллергическая (идиопатическая) форма связана с гиперреактивностью к аллергенам и инфекционным агентам • Токсико-аллергическая (симптоматическая) форма связана с гиперчувствительностью к ЛС • Экссудативная злокачественная форма (см. Синдром Стивенса–Джонсона) • Ревматическая эритема — округлые или дугообразные очаги эритемы на туловище и конечностях, наблюдаемые иногда при ревматической атаке.
Клинические проявления • Местные симптомы •• На коже разгибательных поверхностей предплечий, голеней, тыла кистей и стоп, лице, половых органах, на слизистых оболочках остро возникают симметричные высыпания. Появляются отёчные, чётко отграниченные, уплощённые папулы розово-красного цвета округлой формы, диаметром от нескольких миллиметров до 2–5 см, имеющие две зоны: внутреннюю (серовато-синюшного цвета, иногда с пузырём в центре, наполненным серозным или геморрагическим содержимым) и наружную (красного цвета [кокардообразные высыпания]) •• На губах, щеках, нёбе возникают разлитая эритема, пузыри, эрозивные участки, покрытые желтовато-серым налётом • Общие симптомы •• Жжение и зуд в области высыпаний, болезненность и гиперемия слизистых оболочек, прежде всего рта и половых органов •• Лихорадка •• Головная боль и боль в суставах • Наиболее тяжёлое проявление — синдром Стивенса–Джонсона • При токсико-аллергической форме, в отличие от идиопатической, нет сезонности рецидивов высыпаний.
Методы исследования • Проводят лабораторные исследования для исключения сифилиса — серологические реакции, исследования на бледную трепонему • Симптомы Никольского, Асбо–Хансена отрицательны, в мазках-отпечатках нет акантолитических клеток • При гистопатологическом исследовании в эпидермисе отмечают внутри- и межклеточный отёк, гидропическую дегенерацию базальных клеток, в дерме — отёк сосочкового слоя, периваскулярные инфильтраты.
Дифференциальная диагностика • Ветряная оспа • Буллёзный пемфигоид • Герпетиформный дерматит Дюринга • Опоясывающий герпес • Сифилитические папулёзные высыпания.
Лечение • При лёгком течении — антигистаминные и десенсибилизирующие средства • При пузырях и эрозиях на коже — мази с ГК и антибиотиками (например, окситетрациклин+гидрокортизон) • При поражении слизистой оболочки рта — тёплые полоскания 10% р-ром натрия гидрокарбоната, местными анестетиками (2% р-р лидокаина), а также ГК: дексаметазон (эликсир, 0,5 мг на 5 мл воды) 4 р/сут с последующим проглатыванием • В более тяжёлых случаях и при распространённых буллёзных формах — антибиотики (внутрь или парентерально), ГК (например, преднизолон 1–2 мг/кг/сут с последующим снижением дозы), ингибиторы протеолитических ферментов (апротинин). При синдроме Стивенса–Джонсона — см. Синдром Стивенса–Джонсона.
Прогноз. Исход заболевания в неосложнённых случаях благоприятный. При синдроме Стивенса–Джонсона летальность — 10–30%.
МКБ-10 • L51 Эритема многоформная