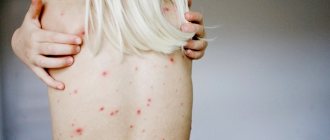
Признаки и код по МКБ-10
Код по мкб 10 нагноения послеоперационной раны присвоен Т81. Клиническая картина поражения области хирургического вмешательства зависит от возбудителя патологии. Внутрь поврежденных кожных покровов могут попадать стафилококки, стрептококки, клостридии, синегнойная палочка, пневмококки. Бактерии размножаются внутри организма. Их активная жизнедеятельность проявляется местными и системными симптомами.
При заражении раны грамположительной флорой у человека наблюдается резкое повышение температуры на 2 или 3 день после операции. Ухудшение общего самочувствия пациент связывает с признаками болезненности поврежденной области.
Во время послеоперационного врачебного осмотра выявляются отек, гиперемия краев кожного дефекта с нагноением. Пальпация вызывает неприятные болевые ощущения. Если инфекционный процесс локализуется под апоневрозом, подкожной жировой тканью, симптомы воспаления проявляются позднее. Несвоевременное выявление патологического процесса заканчивается развитием инфекционных осложнений.
Грамотрицательная флора вызывает температурную реакцию на 3-4 послеоперационный день. Интоксикационный, болевые синдромы выражены ярче, чем при заражении раны грамположительными бактериями. У больного проявляются признаки вовлечения в патологический процесс сердечно-сосудистой системы. Он страдает от сильного сердцебиения, тахикардии, перепадов давления, кардиалгий.
Неклостридиальная анаэробная микрофлора вызывает системные и местные проявления нагноения с первых дней. У пациента наблюдаются высокая температура тела, резкая болезненность в области послеоперационной свежей раны, слабость, снижение аппетита. При осмотре места хирургического вмешательства определяется выраженный отек и гиперемия патологического участка тела. По данным признакам можно заподозрить заражение бактериальными агентами.
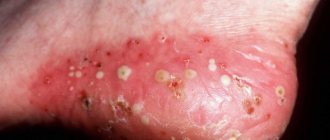
Через 2-3 дня после развития нагноения из раны начинает выделяться секрет. При стафилококковой инфекции он имеет сливкообразную консистенцию, желто-зеленый цвет. От послеоперационной области не исходит неприятный запах.
Признак деятельности синегнойной палочки проявляется образованием сине-зеленого секрета, жидкой консистенции. Заподозрить заражение данным возбудителем помогает специфический запах и характерные выделения из раны.
Диагноз нагноения послеоперационной области устанавливается на основе клинических признаков заболевания, анамнеза, провоцирующих факторов, результатов диагностических исследований.
Лечение длительно незаживающих послеоперационных ран промежности и анального канала
Согласно определению специального заседания Европейского общества репарации тканей, «хронической следует считать рану, не заживающую в течение периода, который является нормальным для ран подобного типа или локализации» [7]. По нашим данным, хроническим считается раневой процесс, существующий более 45 дней без признаков активного заживления.
В последнее время число больных, инфицированных микроорганизмами, передающихся половым путем, продолжает неуклонно расти. Заболевания, передающиеся половым путем (ЗППП), нередко протекают бессимптомно или малосимптомно, поэтому многие пациенты не обращаются к врачу, в этой связи половые инфекции имеют выраженную тенденцию перехода в хроническую форму [2].
В ранах промежности после оперативных вмешательств встречаются полимикробные ассоциации, представленные условно-патогенными бактериями [3], в т. ч. и клинически значимыми, в сочетании с хламидиями, трихомонадами, гарднереллами, микоплазмами, уреаплазмами, цитомегаловирусом (ЦМВ), генитальным герпесом (вирусом простого герпеса 2-го типа (ВПГ-2)), а также кандидой, т. е. возбудителями, передающимися половым путем [1, 4, 8, 11, 12].
Однако работ, посвященных данной проблеме, имеется очень немного, преимущественно они касаются гинекологической и урологической практики. В этой связи для изучения влияния инфекций, передающихся половым путем, на течение раневого процесса мы решили изучить микробиоценоз послеоперационных ран у пациентов после операций на дистальном отделе прямой кишки, анальном канале и промежности.
Было проведено исследование, целью которого являлись изучение раневого микробиоценоза и разработка комплекса специфической корригирующей терапии в послеоперационном периоде, направленной на улучшение результатов лечения больных с длительно незаживающими ранами анального канала и промежности.
Материалы и методы
Исследование проводится с сентября 2010 г. по настоящее время. В исследование было включено 96 человек, оперированных в ФБГУ «Государственный научный центр колопроктологии» по поводу свищей прямой кишки, хронических анальных трещин и геморроя.
Основную группу составили 49 пациентов с вялотекущим раневым процессом, подтвержденным при клинико-цитологическом исследовании, результатом которого явились длительно незаживающие раны (со дня операции прошло от 46 до 118 дней, в среднем – 81,3±49,3). Контрольная группа – 47 больных, у которых по данным клинико-цитологических исследований отклонений в течении раневого процесса отмечено не было, раны зажили в нормальные сроки – в среднем на 37±10,5 дня (р<0,05).
Сравнительный анализ 2-х групп пациентов не выявил существенных различий по половому и возрастному составу. Так, в основной и контрольной группах было больше мужчин – 28 (57,1%) и 29 (61,7%) соответственно. В основной группе была 21 (42,9%) женщина, в контрольной – 18 (38,3%).
Возраст пациентов основной группы колебался от 19 до 74 лет, но в большинстве своем это были люди работоспособного возраста, их средний возраст составил 41,0±13,2 года. У больных контрольной группы (лица от 18 до 72 лет) средний возраст был 42,8±12,2 года.
Также больные были сравнимы и по нозологическим формам. Среди 49 пациентов основной группы было 13 (26,5%) больных с хроническими анальными трещинами, 28 (57,1%) – со свищами прямой кишки и 8 (16,3%) – с геморроем. У большинства пациентов контрольной группы – 24 (51,1%) также диагностированы свищи, у 13 (27,7%) наблюдались трещины и у 10 (21,3%) – геморрой.
Достоверно значимых различий по характеру оперативных вмешательств также выявлено не было. В большинстве случаев у пациентов как основной, так и контрольной групп проводились оперативные вмешательства в объеме иссечения свищей в просвет прямой кишки: у 21 (42,9%) и 17 (36,2%) соответственно. Иссечение свищей с ушиванием сфинктера выполнялось у 3 (6,1%) больных основной группы и у 5 (10,6%) – контрольной. Иссечение свища с низведением лоскута проводилось у 4 (8,2%) пациентов основной группы и 2 (4,3%) – контрольной.
У 21 (42,8%) (11 мужчин и 10 женщин) больного основной группы были указания на наличие в анамнезе ЗППП и заболеваний, которые могли быть обусловлены инфекциями, передающимися половым путем, а у пациентов контрольной группы указаний на такие заболевания не было ни в одном наблюдении (р<0,001). У больных основной группы были выявлены следующие заболевания: 2 (4,1%) наблюдались у уролога по поводу хронического простатита; у 2 (4,1%) пациенток в прошлом диагностирован кольпит, при этом возбудители данного заболевания установлены не были; указание на перенесенный аднексит имело место у 1 (2,0%) больной; 1 пациенту (2,0%) проводилось лечение по поводу синдрома Рейтера; 5 мужчин (10,2%) перенесли трихомониаз; 3 пациента (6,1%) (женщина и двое мужчин) – хламидиоз; 2 пациентки (4,1%) – гарднереллез и 3 (6,1%) – кандидоз, а также 1 (2,0%) – генитальный герпес; 1 больной (2,0%) перенес в прошлом уреаплазмоз (табл. 1).
У всех больных в послеоперационном периоде проводились бактериологические и бактериоскопические исследования отделяемого ран анального канала, уретры, у женщин дополнительно – из цервикального канала: у пациентов контрольной группы – на 25–й день после операции и у пациентов основной группы – на момент обращения, а затем спустя 14 дней от начала проведенного лечения.
При помощи светового микроскопа определяли возбудителей таких инфекций, как трихомониаз, кандидоз, гарднереллез, наличие грамположительных и грамотрицательных кокков и палочек. Кроме того, для диагностики инфекций, передающихся половым путем, использовался метод полимеразной цепной реакции (ПЦР). У всех пациентов, у которых были обнаружены хламидии, микоплазмы, уреаплазмы, гарднереллы, диагноз подтверждался методом прямой иммунофлюоресценции. При выявлении ВПГ-2 и ЦМВ диагноз подтверждался с помощью культурального метода. Микробиологические исследования проводились в бактериологической лаборатории с использованием методики, позволяющей определить количественное содержание и видовой спектр аэробных и факультативно-анаэробных микроорганизмов.
У больных основной группы сразу после обращения по поводу длительно незаживающей раны (на 46–118-й день), а затем через 14 дней от начала лечения проводились цитологические и патоморфологические исследования отделяемого из послеоперационных ран. У пациентов контрольной группы эти исследования проводили на 25-й день после операции.
Результаты
При цитологическом исследовании во время обращения по поводу длительно незаживающей раны у 45 (91,8%) больных основной группы наблюдалась картина «извращенной» репарации – наличие многоядерных клеток типа инородных тел в мазках-отпечатках из ран, а также у всех 49 пациентов – хронический воспалительный процесс с большим количеством неизмененных лейкоцитов. Количество лейкоцитов в ранах от 30 до 40 в поле зрения наблюдалось у 8 (16,3%) больных, 40–60 – у 7 (14,3%), 60–80 – у 9 (18,4%), все поле зрения –у 25 (51%) пациентов. К 25-му дню у всех больных контрольной группы лейкоциты с явлениями дистрофии были в небольшом количестве и не превышали 5 в поле зрения (р<0,001).
Данные цитологического исследования коррелировали с данными, полученными при патоморфологическом исследовании. У пациентов основной группы в биоптате обнаружено большое количество неизмененных нейтрофилов, микрофлора локализуется как вне-, так и внутриклеточно; явления фагоцитоза слабо выражены. У больных контрольной группы в биоптате выявлялись единичные, дистрофически измененные лейкоциты, а также макрофаги и фибробласты.
При микробиологическом исследовании в момент обращения (на 46–118-й день после операции) у всех 49 (100%) больных основной группы в отделяемом послеоперационных ран определялись различные микроорганизмы; у пациентов контрольной группы на 25-й день после операции в 44 (93,6%) из 47 наблюдений были выявлены какие-либо микроорганизмы, а у 3 (6,4%) из них отсутствовал рост в бактериальных посевах.
У пациентов основной группы среди микроорганизмов преобладали Enterococcus faecalis (фекальные стрептококки) – у 28 (57,1%), а также Escherichia coli (кишечная палочка) – у 20 (40,8%); первые встречались более чем в 4 раза чаще, вторые – в 6 раз чаще, чем у больных контрольной группы. Enterobacter cloacae (энтеробактер) в 11 раз чаще обнаруживался у пациентов основной группы по сравнению с больными контрольной (этот микроорганизм обнаружен лишь у 1 больного контрольной группы). Candida albicans (дрожжевой грибок) высевался у 14 (28,6%) пациентов основной группы и у 9 (19,1%) – контрольной.
У пациентов основной группы в бактериальных посевах из послеоперационных ран такие клинически значимые микроорганизмы, как Proteus mirabilis (протей), были обнаружены в 10 (20,4%), Acinetobacter lwoffii (ацинетобактер) – в 4 (8,2%), Staphylococcus aureus (золотистый стафилококк) – в 10 (20,4%), Streptococcus haemolyticus (гемолитический стрептококк) – в 3 (6,1%) наблюдениях. Суммарно частота выявления этих клинически значимых условно-патогенных микроорганизмов у больных основной группы составила 27 (55,1%) случаев, количество микроорганизмов превышало 105 КОЕ. У пациентов контрольной группы клинически значимые микроорганизмы обнаруживались только у 1 (2,1%) пациента (высевался Staphylococcus aureus), микробное число в данном случае составило 105 КОЕ (р<0,001).
Ассоциации микроорганизмов в бактериальных посевах встречались у 47 (95,9%) пациентов основной группы: 5 различных возбудителей обнаружено у 5 (10,2%), 4 – у 5 (10,2%), 3 – у 5 (10,2%), 2 – у 32 (65,3%) больных; тогда как в контрольной группе – лишь у 4 (8,5%) пациентов была выявлена ассоциация 2-х микроорганизмов (р<0,001) (табл. 2).
У всех пациентов основной группы с длительно незаживающими ранами были выявлены различные микроорганизмы, передающиеся половым путем, из них у 98% пациентов обнаружены патогенные возбудители ЗППП, тогда как в контрольной группе этот показатель составил лишь 23,4% (у 11 из 47 больных), при этом все обнаруженные микроорганизмы – возбудители ЗППП у последних были условно-патогенными (р<0,01) (рис. 1).
У 26 (53,1%), т. е. более половины пациентов основной группы, в раневом отделяемом обнаруживались хламидии. При этом Chlamydia trachomatis только у 3 (6,1%) больных была обнаружена также и в уретре, и в цервикальном канале у женщин. В контрольной группе хламидиоз не диагностирован (р<0,001).
Трихомонада была выявлена более чем у трети пациентов основной группы – в 19 (38,8%) случаях: у 2 (4,1%) пациенток в отделяемом из ран, а также уретры, анального и цервикального каналов и у 2 (4,1%) мужчин – в уретре и отделяемом из ран, а у 15 (30,6%) больных – только в отделяемом из послеоперационных ран. В контрольной группе трихомониаз не был обнаружен (р<0,001).
Гарднерелла определялась у 17 (34,7%) пациентов основной группы: у 8 (16,3%) из них этот микроорганизм обнаруживался во всем исследуемом материале, у 9 (18,4%) – только в раневом отделяемом. У 7 (14,9%) пациентов контрольной группы данный микроорганизм выявлялся в 5 (10,6%) наблюдениях во всем исследуемом материале, в 2 (4,3%) – только в отделяемом из уретры и цервикального канала.
Кандида выявлялась в 29 (59,2%) случаях у пациентов основной группы в отделяемом из анального канала, уретры, цервикального канала и послеоперационных ран. В контрольной группе кандидоз был обнаружен у 5 (10,6%) человек также во всем исследуемом материале (р<0,001).
Несколько реже встречались такие внутриклеточные микроорганизмы, как уреаплазма и микоплазма. У 6 (12,2%) пациентов основной группы уреаплазма обнаруживалась во всем исследуемом материале, тогда как в контрольной группе этот микроорганизм определялся у 1 (2,1%) больного только в отделяемом из уретры (р<0,05). В 1 (2,0%) случае у больной основной группы была диагностирована Мycoplasma hominis, которая определялась в отделяемом послеоперационных ран и анального канала. У 1 (2,1%) больного контрольной группы Мycoplasma hominis была обнаружена в отделяемом послеоперационной раны и уретры.
У 6 (12,2%) пациентов основной группы выявлен ВПГ-2: у 3 (6,1%) в материале из уретры, цервикального канала и послеоперационных ран и у 3 (6,1%) только в отделяемом из ран. В контрольной группе ВПГ-2 не встречался (р<0,05).
ЦМВ обнаружен у 10 (20,4%) больных основной группы: у 9 (18,4%) в анальном канале и раневом отделяемом и у 1 (2,0%) пациента в уретре, цервикальном канале и раневом отделяемом; тогда как в контрольной группе – не выявлен ни в одном наблюдении (р<0,001).
Частота выявления трихомонады у больных основной группы только из отделяемого из послеоперационных ран при отсутствии их в отделяемом из гениталий составила 30,6% (в 15 наблюдениях), хламидии – 46,9% (в 23 наблюдениях), ЦМВ – 18,4% (в 9 наблюдениях) и ВПГ-2 – 6,1%. Этот факт свидетельствует о длительно существующем хроническом процессе, при котором бывает трудно обнаружить возбудителей ЗППП, если нет какого-либо провоцирующего фактора. Поскольку возбудители хронической инфекции, передающейся половым путем, находятся в эпителиальной клетке в неактивном, «дремлющем» состоянии, появление раны в области промежности либо анального канала является тем самым провоцирующим фактором, который позволяет хронической латентной инфекции активизироваться.
Возбудители ЗППП у всех 49 пациентов основной группы, у которых они были диагностированы, ни в одном наблюдении не встречались как моноинфекция, а обнаруживались только в ассоциациях с другими возбудителями ЗППП. Наличие сразу 2-х микроорганизмов, вызывающих ЗППП, обнаружены у 33 (67,3%) больных, а у 16 (32,7%) пациентов основной группы встречалось сочетание 3-х возбудителей.
У 11 больных контрольной группы, у которых были выявлены микроорганизмы, передающиеся половым путем, напротив, наиболее часто встречался 1 возбудитель – у 8 (17,0%), сочетание 2-х микроорганизмов выявлено у 3 (6,4%) пациентов, а наличие сразу 3-х и более микроорганизмов ни в одном наблюдении обнаружено не было (р<0,001).
У пациентов основной группы частота обнаружения ассоциаций микроорганизмов составила: трихомонада, ЦМВ и кандида – 10,2% (5 больных); хламидия, трихомонада и кандида – 8,2% (4 пациента); трихомонада, гарднерелла и кандида – 10,2% (5 больных); хламидия и гарднерелла – 20,4% (10 наблюдений); хламидия и кандида – 14,3% (7 больных); трихомонада и кандида – 8,2% (4 случая). У 3 (6,4%) больных контрольной группы кандида встречалась в сочетании с гарднереллой.
Среди ассоциаций условно-патогенных микроорганизмов с возбудителями ЗППП у пациентов основной группы встречались сочетания: золотистого стафилококка с трихомонадой, хламидией и кандидой – у 4 (8,2%) больных; протея с трихомонадой и кандидой – у 3 (6,1%); протея с хламидией и кандидой – у 6 (12,2%). Как уже указывалось, золотистый стафилококк обнаруживался в посеве только у 1 (2,1%) пациента контрольной группы и ассоциировался с кандидой.
Гемолитические стрептококки ассоциировались с энтерококками, хламидией, кандидой и ВПГ-2 у 2 (4,1%) больных, в ассоциации с хламидией и кандидой – у 1 (2,0%) пациента основной группы.
Таким образом, условно-патогенные, клинически значимые микроорганизмы часто ассоциируются с патогенными микроорганизмами, к которым относятся трихомонада, хламидия, ЦМВ и ВПГ-2. Можно сказать, что патогенные микроорганизмы, передаваемые половым путем, создают благоприятные условия для размножения условно-патогенных микроорганизмов, таких как золотистый стафилококк, протей, гемолитический стрептококк и др., что в свою очередь приводит к длительному поддержанию воспалительной раневой реакции и замедлению процессов репарации в ранах.
Всем больным с длительно незаживающими ранами, у которых обнаружены ЗППП, была назначена соответствующая терапия в зависимости от выделенного возбудителя.
При хламидиозе назначались антибиотики с учетом того, что антихламидийный агент должен активно воздействовать на делящиеся ретикулярные тельца. К таким антибиотикам относятся: макролиды (рокситромицин, кларитромицин, джозамицин), тетрациклины (тетрациклин, доксициклин), эритромицин, фторхинолоны (ципрофлоксацин, офлоксацин).
При микоплазмозе и уреаплазмозе пациенты получали антибиотики из следующих групп: макролиды (рокситромицин, клатритромицин, джозамицин), тетрациклины (тетрациклин, доксициклин), фторхинолоны (ципрофлоксацин, офлоксацин), линкозамины (линкомицин, клиндамицин), аминогликозиды (гентамицин, стрептомицин).
При трихомониазе и гарднереллезе использовались препараты, обладающие противопротозойным и противомикробным действием: метронидазол, тинидазол, орнидазол.
Лечение кандидоза проводилось антимикотическими препаратами из групп триазола (флуконазол, итраконазол), имидазола, полиена (нистатин, леворин, амфотерицин В), аллиламина, эхинокандина (каспофунгин).
При генитальном герпесе назначались интерферон и соединения, обладающие интерферониндуцирующей активностью; ингибиторы репликации вирусной нуклеиновой кислоты (аналоги нуклеозидов (ацикловир), аналоги пирофосфата (фоскарнет натрий)).
При ЦМВ-инфекции назначались ингибиторы репликации вирусной нуклеиновой кислоты: ганцикловир, аналоги пирофосфата (фоскарнет натрий), экстракт побегов картофеля.
Всем больным в комплексе с этиотропными препаратами назначались пробиотики для восстановления нормальной флоры ЖКТ.
В результате проведенного лечения отмечено выздоровление всех пациентов с длительно незаживающими ранами, вошедших в основную группу, которое подтверждалось при клиническом, цитологическом и патоморфологическом исследованиях.
Клинический пример: пациентка В., оперированная по поводу чрессфинктерного свища прямой кишки. По поводу длительно незаживающей раны обратилась на 56-й день после операции. В области раны определялись гипергрануляции, которые при контакте легко кровоточили, на отдельных участках рана была покрыта фибрином (рис. 2).
При ПЦР и бактериоскопическом исследовании отделяемого из раны обнаружены трихомонада, хламидия и кандида. Через 3 нед. после проведенной специфической терапии, направленной на элиминацию выявленных инфекционных агентов, рана зажила полностью.
Клинический пример: пациент К., оперирован по поводу экстрасфинктерного свища прямой кишки. На 108-й день после операции при клиническом осмотре – обильное отделяемое из раны слизисто-гнойного и слизисто-сукровичного характера (рис. 3).
Данные клинического обследования коррелировали с цитологическими (рис. 4) и патоморфологическими (рис. 5) исследованиями. При ПЦР и бактериоскопическом исследовании отделяемого из раны обнаружены ЦМВ, ВПГ-2 и кандида. После проведенного этиотропного лечения (противовирусная терапия, антимикотические препараты) рана зажила полностью.
Заключение
1. У больных с длительно незаживающими послеоперационными ранами в анамнезе частота выявленных мочеполовых инфекций и заболеваний, возможно, обусловленных ЗППП, была 42,8%, тогда как у больных контрольной группы анамнестических указаний на перенесенные ЗППП не было (р<0,001).
2. При цитологическом исследовании в мазках-отпечатках из ран у 91,8% больных основной группы наблюдалась картина извращенной репарации. У всех больных контрольной группы к 25-му дню лейкоциты обнаружены лишь в небольшом количестве (до 5 в поле зрения), с явлениями дистрофии (р<0,001).
3. Частота обнаружения таких клинически значимых микроорганизмов, как протеи, гемолитические стрептококки, золотистые стафилококки, ацинетобактер у больных основной группы составила 55,1%. И лишь у 1 (2,1%) больного контрольной группы высеялся золотистый стафилококк (р<0,001). Ассоциации микроорганизмов в бактериальных посевах были обнаружены у 95,9% пациентов основной группы, тогда как в контрольной группе – лишь у 8,5% больных (р<0,001).
4. У всех пациентов основной группы с длительно незаживающими ранами были выявлены различные ЗППП, в т. ч. у 98% – облигатные патогенные микроорганизмы. У 23,4% больных контрольной группы обнаруженные микроорганизмы, передающиеся половым путем, являлись лишь условно-патогенными (р<0,01).
5. У большинства больных с длительно незаживающими ранами трихомонады (30,6%), хламидии (46,9%) и ЦМВ (18,4%), герпесвирусы (6,1%) выявлялись только в отделяемом из ран и не были обнаружены в соскобах из гениталий. Наличие в области промежности либо анального канала раневого дефекта является провоцирующим фактором, который позволяет хронической, латентной инфекции активизироваться.
6. Клинически значимые условно-патогенные микроорганизмы (протей, ацинетобактер, гемолитический стрептококк и золотистый стафилококк) наиболее часто ассоциируются с патогенными микроорганизмами, передающимися половым путем, к которым относятся трихомонады, хламидии, ЦМВ и ВПГ-2.
Причины появления абсцесса на послеоперационном шве
В травматологической, ортопедической, хирургической врачебных практиках принято считать, что любая рана относится к инфицированным. Внутри поврежденных кожных покровов находится определенное количество бактерий. Признаки нагноения могут не проявиться. Чтобы развилось инфицирование послеоперационной области, необходимо наличие одного или совокупности провоцирующих факторов:
- большая глубина дефекта;
- наличие в ране инородных тел, крови;
- достаточное количество бактерий (стафилококков, стрептококков, кишечных палочек, сальмонелл, шигелл);
- наличие некротических тканей в послеоперационной зоне.
Отдельно выделяют причины развития нагноения:
- Появление признаков абсцесса связано с несоблюдением правил асептики, стерилизации медицинскими работниками. Плохо обработанные инструменты, недостаточно вымытые руки хирурга переносят огромное количество бактерий внутрь раны. После удаления патологического очага часть микроорганизмов остается. Они начинают активно размножаться, что приводит к появлению типичных симптомов нагноения послеоперационной области. Зачастую признаки наблюдаются после кесарево сечения, аппендэктомии.
- Патологический процесс в ране может развиться при повышенной чувствительности у пациента к оперативным материалам. В некоторых случаях происходит реакция отторжения имплантов, протезов, перевязочных и шовных элементов. Признаки нагноения появляются через пару дней после хирургического вмешательства.
- Высокий риск развития абсцесса послеоперационной области наблюдается у людей с эндокринными заболеваниями. К ним относится сахарный диабет.
- Признаки нагноения раны появляются на фоне ослабленной иммунной системы. Организм не может бороться с патогенными бактериями, которые окружают человека. Микроорганизмы легко проникают вглубь тканевого дефекта и вызывают типичные симптомы.
- Патологический процесс развивается при переносе вредных микроорганизмов из зараженного очага на здоровые ткани. Во время проведения операции по удалению аппендицита, парапроктита, доли легких, маточных труб, узлов геморроя часть бактерий заносится в область тканевого разреза. В послеоперационной ране начинается нагноение.
- Неправильное наложение лигатурного шва может стать причиной появления признаков гнойного процесса.
Патологическое состояние требует выявления этиологического фактора для назначения адекватной терапии.
Осложнения ран. Основные принципы лечения
Ранения могут сопровождаться разнообразными осложнениями, как сразу после нанесения ран, так и в отдаленные сроки. К осложнениям ран относятся:
· Развитие травматического или геморрагического шока – является наиболее ранним и грозным осложнением. В отсутствие немедленной помощи становится причиной неблагоприятного исхода.
· Серомы – скопления раневого экссудата в раневых полостях, опасные возможностью нагноения. При развитии серомы необходимо обеспечить эвакуацию жидкости из раны.
· Раневые гематомы – образуются вследствие неполной остановки кровотечения. Гематомы являются потенциальными очагами инфекции, кроме того, сдавливая окружающие ткани, приводят к их ишемии. Их необходимо удалять с помощью пункции или при ревизии раны.
· Некрозы окружающих тканей – развиваются при нарушении кровоснабжения в соответствующей области при травматизации тканей во время операции или неправильном наложении швов. Влажные некрозы кожи необходимо удалять из-за опасности появления глубоких скоплений гноя. Поверхностные сухие некрозы кожи не удаляют, так как они выполняют защитную функцию.
· Раневая инфекция – ее развитию способствуют высокий уровень контаминации и высокая вирулентность попавшей в рану микрофлоры, наличие в ране инородных тел, некрозов, скоплений жидкости или крови, повреждение при ранении костей, нервов, сосудов, хроническое нарушение местного кровоснабжения, а также поздняя хирургическая обработка и общие факторы, влияющие на течение раневого процесса. В экспериментальных и клинических исследованиях установлено, что в большинстве случаев для развития инфекционного процесса в ране необходимо, чтобы ее контаминация превысила критический уровень, составляющий 105-106 микроорганизмов на 1 грамм ткани. Среди общих факторов, способствующих развитию раневой инфекции, важную роль играет значительная кровопотеря, развитие травматического шока, предшествующее голодание, авитаминозы, переутомление, наличие сахарного диабета и некоторых других хронических заболеваний.
Развитие пиогенной инфекции вызывается стафилококком, синегнойной палочкой, кишечной палочкой и другими гноеродными бактериями, анаэробной инфекции – клостридиями и неклостридиальной анаэробной микрофлорой, рожистого воспаления — стрептококками. При генерализации раневой инфекции развивается сепсис. Наиболее часто развитие пиогенной раневой инфекции происходит на 3-5 сутки после ранения, реже в более поздние сроки – на 13-15 сутки. Анаэробная инфекция может развиваться очень быстро, при молниеносных формах она диагностируется через несколько часов после ранения.
При попадании в рану с землей, пылью, инородными телами Cl. Tetani возможно развитие столбняка. В отсутствие специфической профилактики вероятность заболевания столбняком при наличии контаминированных ран достигает 0, 8%. Через укушенные раны в организм может проникать вирус бешенства.
· Расхождения краев ран – встречаются при наличии местных или общих факторов, затрудняющих заживление, а также при слишком раннем снятии швов. При лапаротомии расхождение краев раны может быть полным — с эвентрацией, то есть с выхождением наружу внутренних органов, неполным – с сохранением целостности брюшины, и скрытым, когда сохраняется целостность кожных покровов. Расхождение краев раны устраняется оперативным путем.
· Осложнения рубцов – образование гипертрофированных рубцов и келоидов. Гипертрофированные рубцы развиваются при склонности к избыточному образованию рубцовой ткани и чаще всего при расположении раны перпендикулярно к линии Лангера. Келоиды в отличие от гипертрофированных рубцов имеют особую структуру и распространяются за пределы границ раны. Осложнения рубцов ведут не только к косметическим, но и к функциональным дефектам, таким как нарушение ходьбы или функций верхней конечности из-за ограничения объема движений в суставах. Хирургическая коррекция показана при гипертрофированных рубцах с нарушением функции, однако при келоидах она нередко приводит к ухудшению результата лечения.
· Длительно существующие хронические раны могут осложниться развитием малигнизации. Диагноз подтверждает биопсия тканей раны. Лечение оперативное – необходимо радикальное иссечение в пределах здоровых тканей.
Основные принципы лечения ран
Лечение при ранениях обычно проходит в два этапа – этап первой помощи и этап квалифицированной помощи.
¨ Этап первой помощи
При оказании первой помощи на месте ранения решаются две основные задачи: остановка кровотечения и предотвращение дальнейшей микробной контаминации. Первая помощь включает в себя применение доступных методов временной остановки кровотечений, обезболивание, наложение защитной повязки и транспортную иммобилизацию. На этом этапе не следует промывать рану и удалять из нее инородные тела.
¨ Этап квалифицированной помощи
На этапе госпитальной помощи решаются следующие задачи:
· профилактика и лечение раневых осложнений;
· ускорение процесса заживления;
· восстановление функций поврежденных органов и тканей.
Основные принципы лечения ран:
· строгое соблюдение асептики на всех этапах лечения;
· обязательная хирургическая обработка;
· активное дренирование;
· максимально раннее закрытие ран первичными или вторичными швами или с помощью аутодермопластики;
· целенаправленная антибактериальная и иммуннотерапия, коррекция системных нарушений.
Для выбора адекватной тактики лечения ран необходима тщательная оценка ее состояния, при этом оцениваются:
· Локализация, размер, глубина раны, повреждения нижележащих структур, таких как фасции, мышцы, сухожилия, кости.
· Состояние краев, стенок и дна раны, а также окружающих тканей, наличие и характеристика некротических тканей.
· Количество и качество экссудата — серозный, геморрагический, гнойный.
· Уровень микробной контаминации. Критическим уровнем является значение 105 — 106 микробных тел на 1 г ткани, при котором прогнозируется развитие раневой инфекции.
· Время, прошедшее с момента ранения.
¨ Лечение контаминированных ран
Риск развития раневых осложнений при наличии контаминированных ран гораздо выше, чем при асептических ранах. Лечение контаминированных ран состоит из следующих этапов:
· При возможном контакте раны с землей (все травмы с нарушением целостности покровов тела, отморожения, ожоги, гангрены и некрозы тканей, внебольничные роды и аборты, укусы животных) необходимы мероприятия по профилактике специфической инфекции – столбняка, а при укусах животных — и бешенства.
В целях профилактики столбняка вакцинированным пациентам вводят 0, 5 мл столбнячного адсорбированного анатоксина, невакцинированным пациентам – 1 мл анатоксина и 3000 МЕ противостолбнячной сыворотки. Из-за опасности развития анафилактических реакций на белок введение противостолбнячной сыворотки производится по Безредко: сначала 0, 1 мл разбавленной сыворотки вводится внутрикожно, при величине папулы менее 10 мм через 20 минут вводится 0, 1 мл неразведенной сыворотки подкожно, и только при отсутствии реакции на подкожное введение через 30 минут вводится вся доза подкожно.
При укусах животных (собак, лис, волков и др. ), подозрительных на бешенство, или попадании их слюны на поврежденные ткани нельзя производить первичную хирургическую обработку раны. Рана только промывается и обрабатывается антисептиком. Швы не накладываются. Необходим курс подкожного введения антирабической вакцины, который выполняется в специализированных антирабических пунктах, и проведение профилактики столбняка. При наличии поверхностных повреждений (ссадины, царапины) любой локализации кроме области головы, шеи, кистей рук, пальцев ног и гениталий, нанесенных домашними животными, культуральная очищенная концентрированная антирабическая вакцина (КОКАВ) вводится по 1 мл немедленно, а также на 3, 7, 14, 30 и 90 дни. Но если при наблюдении за животным оно остается здоровым в течение 10 суток, то лечение прекращают после 3 инъекции.
При попадании слюны животных на слизистые оболочки, при локализации укусов в области головы, шеи, кистей рук, пальцев ног и гениталий, а также при глубоких и множественных укусах и любых укусах диких животных, кроме введения КОКАВ необходимо немедленное введение антирабического имунноглобулина (АИГ). Гетерологический АИГ назначается в дозе 40 МЕ на кг массы тела, гомологичный – в дозе 20 МЕ на кг массы тела. Большая часть дозы должна быть инфильтрирована в ткани, окружающие рану, остальная часть вводится внутримышечно. Если возможно наблюдение за животным, и оно в течение 10 суток остается здоровым, то введение КОКАВ прекращают после 3 инъекции.
· Во всех случаях контаминированных ран, кроме небольших поверхностных повреждений и случаев, когда имеются косметические и функциональные противопоказания, обязательно проведение первичной хирургической обработки (ПХО) с рассечением раны, ревизией раневого канала, иссечением краев, стенок и дна раны. Цель ПХО в полном удалении нежизнеспособных и контаминированных тканей. Чем позже производится ПХО, тем ниже вероятность предупреждения инфекционных раневых осложнений.
ПХО не проводится при локализации ран на лице, так как приводит к увеличению косметического дефекта, а хорошее кровоснабжение данной области обеспечивает низкий риск нагноений и активное заживление ран. При обширных ранах волосистой части головы выполнение ПХО в полном объеме может привести к невозможности сопоставления краев и закрытия раны. Не подлежат ПХО также колотые непроникающие раны без повреждения крупных сосудов и укушенные раны при подозрении на возможность проникновения вируса бешенства. ПХО может завершаться наложением первичных швов – с ушиванием наглухо либо, при наличии факторов риска нагноения раны, – с оставлением дренажей.
Предпочтительно проточно-промывное дренирование ушитых ран с последующим диализом эффективными антисептиками. Проточно-промывное дренирование осуществляется установкой встречных перфорированных дренажей, по одному из которых вводится лекарственное средство, по другому осуществляется отток. Введение препаратов может быть струйным и капельным, дробным или постоянным. Отток при этом может осуществляться пассивным и активным способом – с помощью вакуумирования.
Данный метод предохраняет раны от вторичного обсеменения, способствует более полному удалению отделяемого, создает условия управляемой абактериальной среды и благоприятные условия для заживления ран. При дренировании необходимо соблюдать несколько общих принципов. Дренаж устанавливают в отлогих местах раневой полости, где максимально скопление жидкости. Выведение дренажной трубки через контрапертуру предпочтительнее, чем через рану, так как дренаж, являясь инородным телом, мешает нормальному заживлению раны и способствует ее нагноению.
При высоком риске развития нагноения раны, например, при наличии резких изменений окружающих тканей, показано наложение первично-отсроченных швов, в том числе провизорных. Как и первичные, эти швы накладываются на рану до развития грануляционной ткани, обычно на 1-5 сутки после ПХО при стихании воспалительного процесса. Заживление таких ран протекает по типу первичного натяжения. Швы не накладываются только после обработки огнестрельных ран и при невозможности сопоставления краев раны без натяжения, в последних случаях показано максимально раннее закрытие раневого дефекта с помощью реконструктивной операции.
· Антибиотикопрофилактика проводится по той же схеме, что и при «грязных» оперативных вмешательствах. Требуется 5-7 дневный курс введения антибиотиков.
· Антисептикопрофилактика предполагает использование эффективных антисептиков на всех этапах операции и при уходе за раной. При обработке ран могут применяться хлоргексидин, гипохлорит натрия, диоксидин, лавасепт, перекись водорода, перманганат калия и другие антисептики. Такие препараты, как фурацилин, риванол, хлорамин, в настоящее время не рекомендуются для использования в хирургических отделениях, так как госпитальная микрофлора устойчива к ним практически повсеместно.
· Ведение раны после проведения ПХО при наложении швов аналогично ведению операционных ран. Выполняется регулярная смена асептических повязок и уход за дренажами. Лечение открытых ран после ПХО производится, как и лечение гнойных ран, в соответствии с фазами течения раневого процесса.
¨ Лечение гнойных ран
Лечение гнойных ран комплексное — оперативное и консервативное.
· Во всех случаях инфицированных ран, когда нет особых функциональных противопоказаний, производится вторичная хирургическая обработка (ВХО). Она заключается во вскрытии гнойного очага и затеков, эвакуации гноя, иссечении нежизнеспособных тканей и обязательном обеспечении адекватного дренирования раны. Если после проведения ВХО рана не ушивалась, в последующем возможно наложение вторичных швов. В отдельных случаях при радикальном иссечении гнойника при ВХО могут быть наложены первичные швы с обязательным дренированием раны. Предпочтительно проточно-промывное дренирование. При наличии противопоказаний к проведению ВХО ограничиваются мероприятиями по обеспечению адекватной эвакуации экссудата.
· Дальнейшее местное лечение гнойных ран зависит от фазы течения раневого процесса.
В фазе воспаления основные задачи лечения – борьба с инфекцией, адекватное дренирование, ускорение процесса очищения раны, снижение системных проявлений воспалительной реакции. Основой является лечение повязками. Для всех ран, заживающих вторичным натяжением, стандартным методом лечения считается влажная обработка. Сухая обработка с наложением на рану сухих стерильных салфеток используется только для временного покрытия ран и обработки ран, заживающих первичным натяжением.
При влажной обработке используются повязки, создающие в ране влажную среду. Используются осмотически-активные вещества, антисептики, водорастворимые мази. Жирорастворимые мази противопоказаны, так как мешают оттоку отделяемого. Возможно использование современных атравматичных перевязочных средств с высокой абсорбционной способностью, сохраняющих определенный уровень влажности и способствующих удалению из раны экссудата и прочному удерживанию его в повязке. Современные комбинированные препараты для местного лечения ран содержат иммобилизованные ферменты — гентацикол, лизосорб, дальцекс-трипсин.
Смена повязок должна происходить при адекватном обезболивании. Частота смены повязок зависит от состояния раны. Обычно требуется 1-2 смены повязок в день, гидроактивные повязки типа «Гидросорба» могут оставаться на ране несколько дней, необходимость немедленной смены повязки возникает в следующих случаях: пациент жалуется на боль, развилась лихорадка, повязка промокла или загрязнилась, нарушилась ее фиксация. На каждой перевязке рану очищают от гноя и секвестров, иссекают некрозы и промывают антисептиками. Для промывания раны могут использоваться хлоргексидин, гипохлорит натрия, диоксидин, лавасепт, перекись водорода, озонированные растворы. Для ускорения некролиза применяются протеолитические ферменты, УЗ-кавитация, вакуумная обработка раны, обработка пульсирующей струей. Из физиотерапевтических процедур показано УФО раны, электро- и фонофорез с антибактериальными и аналгезирующими веществами.
В фазе регенерации основные задачи лечения – продолжение борьбы с инфекцией, защита грануляционной ткани и стимуляция процессов репарации. Необходимость в дренировании уже отсутствует. Повязки, накладываемые в фазу регенерации, должны защищать рану от травматизации и инфекции, не склеиваться с раной и регулировать влажность среды в ране, препятствуя как высыханию, так и избыточной влажности. Применяют повязки с жирорастворимыми антибактериальными мазями, стимулирующими веществами, современные атравматичные повязки.
После полного очищения раны показано наложение вторичных швов или лейкопластырное сопоставление, при больших дефектах — аутодермопластика. В отличие от первичных швов, вторичные швы накладываются на гранулирующие раны после ликвидации воспалительного процесса. Целью является уменьшение объема раневого дефекта и входных ворот для инфекции. Позже 21 суток вторичные швы накладывают только после иссечения образовавшейся рубцовой ткани. В случаях невозможности сопоставления краев для закрытия дефекта производят аутодермопластику в максимально ранние сроки – сразу после стихания воспалительного процесса.
В фазе реорганизации рубца основная задача лечения – ускорение эпителизации и защита раны от травматизации. Так как при высыхании образуется корка, замедляющая эпителизацию, а при избыточной влажности погибают эпителиальные клетки, повязки по-прежнему должны поддерживать рану в умеренно влажном состоянии и защищать от травматизации. Накладываются повязки с индифферентными и стимулирующими мазями. Иногда применяется физиотерапия — УФО, лазер, пульсирующее магнитное поле.
· Общее лечение гнойных ран включает антибактериальную терапию, дезинтоксикацию, иммуннотерапию, симптоматическое лечение.
Антибактериальная терапия применяется в 1-2 фазах раневого процесса. Препарат необходимо назначать с учетом чувствительности микрофлоры раны. Показано системное введение антибиотиков, топическое введение в настоящее время не рекомендуется. Первичный эмпирический выбор антибактериальной терапии до получения результатов чувствительности должен быть направлен против типичных возбудителей, которыми являются стафилококки, стрептококки и грамотрицательные аэробные бактерии.
Используются амоксиклав, левофлоксацин, в качестве резерва – цефуроксим, ципрофлоксацин, офлоксацин, а при укусах — доксициклин. Лечение стафилококковых раневых инфекций при резистентности возбудителя требует назначения ванкомицина или линезолида. При рожистом воспалении показаны пенициллины, азитромицин, линкосомиды. Если инфекция вызвана синегнойной палочкой, препаратами выбора являются карбенициллин, тазоцин, тиментин, а также цефалоспорины 3 поколения и фторхинолоны. Кроме антибиотиков при лечении гнойных ран используются бактериофаги.
Детоксикация применяется при наличии системных проявлений воспалительного процесса. Используются инфузии солевых растворов, детоксицирующих растворов, форсированный диурез, в тяжелых случаях – экстракорпоральная детоксикация.
Иммунокорригирующая терапия может быть специфическая (вакцинами, сыворотками, анатоксинами) и неспецифическая. Часто применяются столбнячный анатоксин, противостолбнячная и противогангренозная сыворотка, противостолбнячный и антистафилококковый гамма-глобулин. Из средств неспецифической иммунотерапии у больных с гнойными ранами используются только иммуномодуляторы, причем лишь при наличии иммунных нарушений и обязательно в комплексе с антимикробным препаратом, так как они обостряют течение инфекции. Синтетические иммуномодуляторы, такие как диоцефон, полиоксидоний, являются наиболее перспективными. Полиоксидоний имеет свойства не только восстанавливать нарушенный иммунный ответ, но и сорбировать токсины, а также является антиоксидантом и мембраностабилизатором. Обычно назначается по 6 мг 2 раза в неделю, полный курс 5-10 инъекций.
Симптоматическая терапия включает купирование болевого синдрома, коррекцию нарушений органов и систем, коррекцию нарушений гомеостаза. Для обезболивания применяются обычно ненаркотические анальгетики, однако в раннем послеоперационном периоде, а также при обширных повреждениях могут использоваться наркотические препараты. При подъеме температуры выше 39° С или лихорадке на фоне тяжелых заболеваний сердечно-сосудистой и дыхательной системы требуется назначение жаропонижающих средств.
¨ Профилактика инфекционных осложнений операционных ран
Операционные раны наносятся в условиях, минимизирующих риск раневых осложнений. Кроме того, до нанесения раны имеется возможность проведения профилактики раневых осложнений. Профилактика осложнений операционных ран включает:
· Проведение подготовки к операции
Перед плановой операцией проводится тщательное обследование пациента, в ходе которого выявляются имеющиеся факторы риска раневых осложнений. При оценке степени риска учитывается возраст, состояние питания, иммунный статус пациента, сопутствующие заболевания, нарушения гомеостаза, предшествующее медикаментозное лечение, состояние тканей в зоне предполагаемого разреза, вид и длительность предстоящего оперативного вмешательства. Производится коррекция имеющихся нарушений и непосредственная подготовка больного к операции с учетом требований асептики.
При операциях на толстой кишке, а также при обширных оперативных вмешательствах у крайне тяжелых больных для профилактики инфекционных осложнений проводится селективная деконтаминация кишечника. Селективная деконтаминация кишечника снижает риск энтерогенного инфицирования, происходящего в результате транслокации кишечных микроорганизмов. Обычно используется сочетание аминогликозида или фторхинолона с полимиксином и амфотерицином В или флуконазолом.
С каждым днем пребывания в стационаре увеличивается обсемененность пациента возбудителями госпитальных инфекций, поэтому этап стационарной предоперационной подготовки не следует затягивать без необходимости.
· Тщательное соблюдение оперативной техники
При выполнении оперативного вмешательства необходимо аккуратное обращение с тканями, тщательный гемостаз, сохранение кровоснабжения тканей в области раны, облитерация образующегося «мертвого» пространства, сопоставление краев раны и их сшивание без натяжения. Швы не должны быть ишемизирующими, но должны обеспечивать полное смыкание краев раны. По возможности, шовный материал, оставляемый в ране, должен быть рассасывающимся и монофиламентным. Кроме того, большую роль играет длительность операции. С ее увеличением возрастает степень контаминации раны и восприимчивость тканей к возбудителям раневой инфекции за счет подсыхания тканей, нарушения кровоснабжения, реактивного отека.
· Антибиотикопрофилактика
Антибиотикопрофилактика инфекционных раневых осложнений зависит от вида оперативного пособия. При чистых операциях она показана только при наличии факторов, неблагоприятно влияющих на течение раневого процесса, таких как имуннодефицитные состояния, сахарный диабет, прием имуннодепрессантов. При большинстве чистых и условно-чистых операций, а также при загрязненных вмешательствах на верхних отделах ЖКТ для антибиотикоприфилактики могут использоваться цефалоспорины 1-2 поколения, такие как цефазолин или цефуроксим. При загрязненных операциях на толстой кишке, желчевыводящей системе и внутренних половых органах показано применение защищенных аминопенициллинов или цефалоспоринов 1-2 поколения в сочетании с метронидазолом.
При проведении периоперационной профилактики используются средние терапевтические дозы антибиотиков. Первую дозу препарата вводят внутривенно за 30-60 минут до кожного разреза, обычно во время вводной анестезии. При длительности операции более 2-3 часов требуется повторное введение антибиотика для поддержания его терапевтической концентрации в тканях в течение всего оперативного вмешательства. В большинстве случаев продолжительность введения антибиотиков не превышает 24 часов, однако наличие дополнительных факторов риска обуславливает необходимость продления профилактики до 3 суток. При «грязных» вмешательствах показан полноценный курс антибиотикотерапии, который следует начинать еще в предоперационном периоде.
· Антисептикопрофилактика
Антисептикопрофилактика предполагает использование эффективных антисептиков на всех этапах операции, в том числе для обработки кожи, промывания полостей, подкожной клетчатки. Общие требования к используемым антисептикам: широкий спектр действия, высокая бактерицидность, токсикологическая безопасность. Для обработки кожи обычно используются йодофоры, хлоргексидин, поверхностно-активные вещества, для промывания полостей — хлоргексидин, гипохлорит натрия, диоксидин.
· Дренирование операционных ран
Дренирование операционных ран проводится по определенным показаниям. Оно необходимо при невозможности облитерации образующегося после операции «мертвого пространства», при большой площади раневой поверхности подкожно-жировой клетчатки, при использовании искусственных материалов для пластики апоневроза и в некоторых других случаях, создающих предпосылки для образования сером. Дренирование также обязательно при радикальном иссечении гнойников с ушиванием послеоперационной раны. Предпочтительно аспирационное или проточно-промывное дренирование, при этом обязателен правильный уход за дренажной системой в послеоперационном периоде.
· Правильное ведение раны в послеоперационном периоде
Назначается холод местно сразу после операции, адекватное обезболивание, производится регулярная смена асептических повязок и уход за дренажами, по показаниям – диализ и вакуумирование раны, физиотерапия и прочие мероприятия.
¨ Контроль лечения ран
Эффективность лечения ран оценивается по динамике общих и местных признаков воспаления. Ориентируются на стихание лихорадки, лейкоцитоза, болей в области раны, нормализацию общего самочувствия больного. Во время перевязок визуально оценивают состояние швов, наличие и распространенность гиперемии и отека в окружности раны, некрозов краев раны, вид раневого отделяемого и грануляций. Для контроля течения раневого процесса при лечении дренированных ран могут применяться инструментальные методы исследования.
Используется эндоскопический метод осмотра раны с одновременной биопсией подкожно-жировой клетчатки для бактериологического исследования. При этом во время перевязки через дренаж послеоперационной раны вводится оптическая трубка эндоскопа с торцевой оптикой диаметром 3-6 мм, оценивается наличие раневого экссудата, участков некроза, фибрина, затем берется биопсия. Степень обсемененности ткани раны определяется с использованием экспресс-методик, например, методом фазово-контрастной микроскопии. После взятия биопсии раневой канал заполняют физиологическим раствором для оценки правильности расположения дренажей и направления потока жидкости при ее струйном введении.
Благоприятными эндоскопическими признаками течения раневого процесса и показанием к прекращению дренирования являются: наличие ярко-розовых грануляций, отсутствие гноя, некрозов, значительного количества фибрина, обсемененность ткани ниже критической. Вялые грануляции, наличие в ране большого количества экссудата и фибрина, а также высокая бактериальная обсемененность требуют продолжения диализа раны растворами антисептиков.
После удаления дренажных систем для оценки состояния раневого канала и окружающих тканей показано ультразвуковое сканирование. Благоприятными ультразвуковыми признаками течения раневого процесса являются:
· сужение раневого канала на следующие сутки после удаления дренажных трубок, визуализация его в виде неоднородной эхонегативной полоски к 3-5 суткам, отсутствие дилятаций и исчезновение канала к 6-7 суткам;
· равномерная эхогенность окружающих тканей, отсутствие в них дополнительных образований.
Неблагоприятными ультразвуковыми признаками течения раневого процесса являются дилятация дренажного канала и повышение эхогенности окружающих тканей с появлением в них дополнительных образований. Данные симптомы указывают на развитие гнойно-воспалительных раневых осложнений еще до появления их клинических признаков.
При лечении гнойной раны необходим ежедневный контроль за течением раневого процесса. При продолжающейся экссудации и вялой грануляции требуется коррекция лечения. Кроме визуальной оценки состояния раны и оценки выраженности общих клинических и лабораторных симптомов применяются различные методы контроля за динамикой микробного пейзажа, уровня обсемененности и регенераторных процессов в тканях: бактериологические, цитологические, современные высокоточные – газожидкостная хроматография, тесты с использованием ферментных систем и прочие.
Как лечат такое нагноение
К лечению послеоперационного повреждения приступают после проведения дополнительных методов исследования. Пациенту назначаются общеклинические анализы. Они помогают установить наличие лабораторных признаков воспаления раны.
Лечебное устранение гнойного инфильтрата зависит от стадии болезни. На начальном этапе формирования нагноения хирург очищает рану от патологического содержимого, назначает противовоспалительные и противомикробные препараты, проводит дезинтоксикационную терапию.
При появлении признаков послеоперационного нагноения, что соответствует второй стадии, повторно очищают рану и применяют препараты для ее заживления. Заключительный период заболевания требует назначения средств для стимуляции образования эпителия.
Основным способом лечения признаков послеоперационного нагноения является хирургическая обработка. Процедура представляет собой малотравматичный род оперативного вмешательства. После иссечения краев раны зона тщательно исследуется. На больном участке выявляются гнойные затеки, инородные предметы. Они могут быть причиной абсцесса. Хирург рассекает затеки и удаляет некротические ткани. Процедура заканчивается постановкой дренажа на место локализации инфицированной полости. Швы не накладываются.
Патологический участок с нагноением смазывается местными антибиотиками, антисептиками, препаратами для заживления раны. Боль купируется анальгетиками. Выраженные признаки интоксикационного послеоперационного синдрома лечатся жаропонижающими медикаментами. При выполнении лечебных мероприятий ситуация заканчивается образованием небольшого шрама.
Нуждаетесь в совете опытного врача?
Получите консультацию врача в онлайн-режиме. Задайте свой вопрос прямо сейчас.
Задать бесплатный вопрос
Традиционные методы для устранения признаков нагноения можно заменить современными. К ним относится вакуум-терапия, лазерная и озонотерапия, криодеструкция, введение в рану абсорбентов.
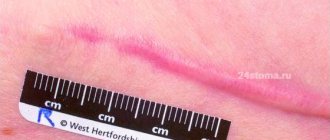
Для профилактики появления признаков бактероидной реакции в виде нагноения необходимо соблюдать правила асептики/антисептики, регулярно менять повязки, накладывать правильно швы, покупать в аптеке эффективные препараты. Лигатурный абсцесс послеоперационного рубца – обратимое состояние раны, которое имеет благоприятный прогноз.
Гипертрофические и келоидные рубцы
Рубцы это результат замещения поврежденных собственных тканей на грубую соединительную в результате оперативных вмешательств и различных травмирующих факторов (механических, температурных, химических, ионизирующего излучения, глубокого деструктивного воспаления и т. д.) [1, 2, 3]. Рубцы, являясь выраженным косметическим недостатком, часто приводят к психоэмоциональному дискомфорту, а также к развитию психосоциальной дезадаптации и снижению качества жизни.
Формирование рубца проходит несколько стадий:
- 1 стадия — воспаление и эпителизация на 7–10 сутки после травмы. Края раны соединяются непрочной грануляционной тканью, рубца как такового еще нет. Этот период очень важен для формирования тонкого и эластичного рубца — необходимо не допускать нагноения и расхождения краев раны.
- 2 стадия — образование молодого рубца. Это 10–30 сутки после травмы. В грануляционной ткани начинают формироваться волокна коллагена и эластина. Сохраняется повышенное кровоснабжение травмы — рубец насыщенно-розового цвета.
- 3 стадия — образование «зрелого» рубца длительностью от 1 до 3 месяцев после травмы, полностью исчезают сосуды, волокна коллагена выстраиваются вдоль линий наибольшего натяжения. Рубец становиться светлым и плотным.
- 4 стадия — окончательная трансформация рубца. Длительность 4–12 месяцев после травмы.
Образование рубца происходит в основном за счет внеклеточного матрикса, в частности с помощью коллагена. Внеклеточный матрикс — это супромолекулярный комплекс, включающий химические соединения различного типа (белки, полисахариды, протеогликаны и прочие). Его можно сравнить с гелем, в котором «плавают» волокнистые протеины (коллагены и эластин) и вязкие протеины (фибронектин, ламинин), обеспечивающие взаимосвязи молекул друг с другом и с поверхностями клеток [2, 9, 14, 17]. Из всех протеинов коллагены составляют основной компонент внеклеточного матрикса и являются наиболее распространенными протеинами организма, занимая около 1/3 части всех его белков. Это нерастворимые в воде внеклеточные гликопротеины, синтезируемые фибробластами, хондробластами и остеобластами. Из-за формы белковой молекулы коллагены относят к фибриллярным белкам [16]. Рост избыточного внеклеточного матрикса в рубце происходит в результате деятельности «раневых» фибробластов. В интактной (здоровой) коже фибробласты отвечают за ремодулирование компонентов дермы, они разрушают старый коллаген и откладывают новый. При ранениях, травмах, ожогах и оперативных вмешательствах в ранах появляются миофибробласты, которые стремятся «заделать брешь» в тканях, усиленно откладывая компоненты внеклеточного матрикса: коллаген, гликозаминогликаны, эластин и другие белки. Именно из-за пролиферации фибробластов и продуцирования ими избыточного внеклеточного матрикса и происходит рост рубцов [2,19].
Можно выделить следующие разновидности рубцов: нормотрофические, гипертрофические и атрофические. При нормальном физиологическом процессе происходит формирование нормотрофического рубца. Это плоские рубцы светлого цвета с нормальной или сниженной чувствительностью и эластичностью, близкой к нормальным тканям. Такие рубцы являются оптимальными. В типичной ране спустя 6–8 недель после повреждения устанавливается равновесие между анаболическими и катаболическими процессами. В этой стадии, прочность раны составляет приблизительно 30–40% прочности здоровой кожи. С развитием рубца предел его прочности увеличивается в результате прогрессивных связей волокон коллагена.
При избыточной реакции соединительной ткани на травму на фоне неблагоприятных условий заживления (воспаление, растяжение рубца и т. д.) формируются гипертрофические рубцы. В условиях гипоксии и воспаления происходит активизация фибробластов биологически активными веществами. Появляются недифференцированные, патологические, функционально активные клетки с высоким уровнем синтеза коллагена. Образование коллагена преобладает над его распадом из-за уменьшения выработки коллагеназы, специфического фермента, разрушающего коллаген, вследствие чего развивается мощный фиброз тканей в виде гипертрофических или келоидных рубцов. Гипертрофические рубцы часто объединяют в общую с келоидными рубцами группу в связи с тем, что оба вида отличаются избыточным образованием фиброзной ткани и возникают в результате неадекватного воспаления, присоединения вторичной инфекции, снижения местных иммунологических реакций и т. д. Однако имеются и существенные различия, на основании которых проводится дифференциальная диагностика между этими двумя видами рубцов, которые будут упоминаться ниже [3].
Атрофические рубцы возникают в результате сниженной реакции соединительной ткани на травму. Коллагена образуется недостаточно. Атрофические рубцы располагаются ниже уровня окружающей кожи (западают). При небольшой ширине они практически не отличаются от нормотрофических. Нередко атрофические рубцы возникают на местах бывших эксфолиаций (угревой болезни) — так называемое «постакне».
Келоид (keloidum: греч. kele выбухание, припухлость + eidos вид; син.: Алибера келоид) — плотное разрастание соединительной ткани кожи, напоминающее опухоль [2]. Келоидные рубцы развиваются как следствие извращенной реакции тканей на травму, это особая, наиболее тяжелая группа рубцов, отличающихся от других по виду и патогенезу. Как правило, келоиды образуются на фоне сниженных показателей общего и тканевого иммунитета. При исследовании келоидной ткани обнаруживаются чрезвычайно активные фибробласты, степень их активности в 4 раза выше, чем у клеток при нормальном процессе заживления [9]. Коллаген (большей частью незрелый) располагается в виде широких рыхлых пучков и узлов, эластин отсутствует. Келоидный рубец имеет упругую консистенцию, неровную, слегка морщинистую поверхность. Келоид принято классифицировать на истинный и ложный. Истинный (самопроизвольный) келоидный рубец возникает спонтанно без каких-либо предпосылок, чаще на коже груди, по наружной поверхности верхней трети плеча, в редких случаях — по всему телу. Ложный келоид может развиваться в любом месте, где до этого наблюдалась травма кожных покровов (механическая, ожог и т. д.). Например, казуистический случай наблюдали Chawla B., Agarwal A., Kashyap S. (2007), которые диагностировали келоидное образование на роговице глаза после операции. В настоящее время данная классификация носит относительный характер. Большинство исследователей полагают, что самопроизвольному келоиду предшествует микротравматизация кожи и этиологически он ничем не отличается от ложного (по патогенезу и морфологии эти рубцы абсолютно идентичны) [2]. Келоид на месте ссадин или царапин представляет собой возвышение. Цвет и интенсивность окраски зависит от степени васкуляризации (ярко-розовый, бледный, цианотичный). Для келоидного рубца характерен пульсирующий рост, подобно приливу-отливу. Рубцовая ткань при келоиде простирается за границы первоначальной раны, обычно не регрессирует спонтанно и имеет тенденцию рецидивировать после иссечения.
Теоретически келоид может появляться в любом возрасте, но чаще развивается во время и после пубертата. Юные индивидуумы более часто травмируются, и молодая кожа создает большее натяжение, в то время как кожа пожилых менее эластична и более регидна. Уровень синтеза коллагена также выше в более молодом возрасте. В настоящее время определен средний возраст пациентов — 25,8 (22,3 у женщин и 22,6 у мужчин) [5].
Обычно диагностика келоида не представляет трудностей. Gulamhuseinwala N., Mackey S., Meagher P. (2008), проведшие ретроспективное исследование 568 пациентов с келоидами, установили, что клинический диагноз совпадал с гистологическим в 94% случаев. Однако при дебюте возникновения рубцов встает вопрос дифференциального диагноза между гипертрофическим рубцом и келоидом. Как уже упоминалось выше, имеются существенные различия между этими видами рубцов. Рост гипертрофического рубца начинается сразу же после заживления и характеризуется образованием «плюс ткани», по площади равной раневой поверхности, в то время как границы келоида всегда выходят за зону повреждения. При гипертрофическом рубце субъективные ощущения отсутствуют или незначительные. Келоидные образования вызывают различные субъективные ощущения (зуд, боль, чувство стянутости кожи, парастезии и т. д.). Изменение цвета гипертрофического рубца от розового до белесоватого происходит в те же сроки, что и у нормотрофических рубцов, и со временем они заметно уплощаются. Келоид остается насыщенного цвета и спонтанно не регрессирует. Обычно у одного больного наблюдается несколько келоидных образований. Келоидный рубец чаще встречается у людей в возрасте 10–30 лет, в то время как гипертрофические шрамы могут возникнуть в любом возрасте. Морфологическая картина также имеет существенные различия. Известно, что синтез коллагена в келоидах приблизительно в 8 раз выше, чем в гипертрофических рубцах, что объясняет меньшее количественное содержание коллагеновых волокон в гипертрофических рубцах, а следовательно, и массу рубца. В гипертрофических рубцах клеток фибропластического ряда меньше, чем в келоидных, отсутствуют гигантские, незрелые формы «зоны роста» [1, 7, 8, 9, 12, 21].
Исследователями отмечена неодинаковая частота локализации келоидообразования у лиц имеющих, различную расовую принадлежность. Например, у белокожих келоид чаще образуется на лице (щека и ушная раковина), верхних конечностях и стернальной области; а у азиатов стернальная область почти не поражается, у чернокожих наряду с ушной раковиной и шеей чаще затрагиваются нижние конечности [5]. Это дало предположение о ведущей роли наследственности келоидообразования. Однако до настоящего времени никакой определенный ген или набор генов не был идентифицирован как отвечающий за развитие келоида [5, 8]. Кроме того, не выявлены никакие существенные различия между ДНК-фибробластами келоида и ДНК-фибробластами нормальной кожи. Это предполагает, что в развитии келоидообразования имеет значение не увеличение числа фибробластов, производящих нормальное количество коллагена, а то, что каждый фибробласт производит больше коллагена, чем необходимо для восстановления раны [13].
Лечение келоида и гипертрофических рубцов
Первое правило при лечении келоида и гипертрофических рубцов — это их предупреждение. Во-первых, необходимо избегать ненужной косметической хирургии у пациентов, предрасположенных к образованию келоида и грубых рубцов. Возможным исключением может быть обезображивающий келоид на ушной раковине. Если операции не избежать, то закрытие всех хирургических ран должно происходить с минимальным натяжением по складкам кожи, когда это возможно. Желательно, чтобы разрезы не проходили через поверхность суставов и в средней части груди.
Методы лечения келоида и гипертрофических шрамов можно разделить на несколько групп:
- медикаментозные (кортикостероиды, иммуномодуляторы, препараты, влияющие на коллагенобразование);
- физические и физиотерапевтические (использование окклюзивных повязок и компрессионной терапии, иссечение, криохирургия, лазерная терапия, электрофорез и т. д.);
- лучевая терапия;
- косметические процедуры, направленные на внешнюю коррекцию дефекта.
Лекарственные средства
Кортикостероиды. Внутрирубцовое введение стероидов остается основой лечения. Кортикостероиды уменьшают рубцеобразование посредством уменьшения синтеза коллагена, глюкозаминогликанов, медиаторов воспаления и пролиферации фибробластов в процессе заживления раны. Наиболее часто используемый кортикостероид — триамцинолона ацетат в концентрации 10–40 мг/мл, назначаемый в зону повреждения посредством введения иглой с интервалом 4–6 недель. Эффективность такого введения, как мономодели и как добавление к процедуре эксцизии рубца, очень высока. Также широко применяются топические кортикостероидные средства, которые наносятся ежедневно непосредственно на образование. Осложнения при лечении кортикостероидами включают атрофию, телеангиоэктазии и нарушения пигментации.
Иммуномодуляторы. Новым методом в лечении келоидных и гипертрофических рубцов является терапия интерфероном. Интерферон, введенный в линию шва, после иссечения келоидного рубца может профилактически предотвращать рецидивы. Рекомендуется вводить по 0,5–1,0 млн. МЕ через день 2–3 недели, затем по 0,1–0,5 млн. МЕ 1–2 раза в неделю в течение трех месяцев.
Препараты, уменьшающие гиперпролиферацию клеток соединительной ткани. Классическим средством для лечения рубцов является гиалуронидаза. Гиалуронидаза расщепляет основной компонент межуточного вещества соединительной ткани — гиалуроновую кислоту, являющуюся цементирующим веществом соединительной ткани, и, таким образом, повышает тканевую и сосудистую проницаемость, облегчает движение жидкостей в межтканевых пространствах; уменьшает отечность ткани, размягчает и уплощает рубцы, предупреждает их формирование. Препараты, содержащие гиалуронидазу (Лидаза и Ронидаза), получают из семенников крупного рогатого скота. Раствор Лидазы (1 мл) вводят в этих случаях вблизи места поражения под кожу или под рубцово-измененные ткани. Инъекции производят ежедневно или через день; курс лечения состоит из 6–10–15 и более инъекций. При необходимости проводят повторные курсы с промежутками 1, 5–2 мес.
Новым ферментным препаратом для лечения заболеваний, сопровождающихся ростом соединительной ткани, является «Лонгидаза». «Лонгидаза» это химическое соединение гиолуронидазы с полиоксидонием. Сочетание ферментативной активности гиалуронидазы с иммуномодулирующими, антиоксидантными и умеренными противовоспалительными свойствами полиоксидония, обеспечивает широту фармакологических свойств. Наиболее эффективно использовать препарат «Лонгидаза» методом ультрофонофореза или фонофореза. При ультрофонофорезе Лонгидаза 3000 МЕ разводится в 2–5 мл геля для ультразвуковой терапии. Воздействие осуществляется малым ультразвуковым излучателем (1 см2), с частотой ультразвука 1 МГц, интенсивностью 0,2–0,4 Вт/см2, в непрерывном режиме, время воздействия 5–7 мин., курс 10–12 процедур ежедневно или через 1 день. Методом фонофореза (1500 Гц) 3000 МЕ Лонгидазы вводится ежедневно (общее время воздействия 5 мин., курс — 10 процедур). Также возможно введение препарата внутрь рубца:
- келоидные и гиперторофические рубцы небольших размеров: Лонгидаза 3000 МЕ 1 раз в 7 дней общим курсом 10 инъекций внутрь рубца;
- келоидные и гипертрофические большой площадью поражения: Лонгидаза 3000 МЕ 1 раз в 7 дней внутрь рубца курсом 8–10 инъекций, одновременно внутримышечное введение Лонгидазы 3000 МЕ № 10.
Хорошо известным препаратом, тормозящим пролиферацию клеток соединительной ткани и одновременно оказывающим противовоспалительный эффект, является Контрактубекс. В течение многих лет Контрактубекс применяется в хирургии и косметологии в лечении послеоперационных и послеожоговых рубцов, в том числе грубых, препятствующих движению и келоидных, а также растяжек (стрий) после родов или после резкого снижения веса.
Ферментный препарат из 9 коллагенолитических протеаз «Ферменкол» представляет собой принципиально новый протеолититческий препарат. Противорубцовый эффект Ферменкола основан на редукции избыточного внеклеточного матрикса в рубцовой ткани. Эффект при использовании противорубцовых средств наблюдается примерно через 3 недели после начала применения средства и достигает оптимального результата обычно после 2–3 курсов электрофореза или фонофореза, по 10–15 сеансов или аппликаций в течение 30–60 дней.
Физические и физиотерапевтические методы
С разным успехом в лечении гипертрофических рубцов и келоида применяются силиконовые пластинки и силиконовые обтурирующие повязки. При применении силиконовых повязок в большей степени эффект проявляется в результате комбинации давления и гидрации поверхности, чем эффект от самого силикона. Исследования показывают, что действенность таких повязок при их использовании 24 часа в сутки в течение 12 месяцев наблюдалась только у ≈1/3 пациентов [20]. Метод сжатие/давление, достигаемый с помощью силиконовых пластин, вызывает истончение кожи. В одном исследовании прикладывание двух пластин к ушным мочкам после удаления келоида предотвращало его рецидивирование в срок от 8 месяцев до 4 лет. Выраженным дискомфортом метода является необходимость ношения повязок/пластинок в течение суток, а также невозможность их прикрепления в некоторых анатомических областях (сгибы, шея и т. д.). Другие устройства (специальное компрессионное белье и пластырь с оксидом цинка) также используются от 12 до 24 часов в день в течение 8–12 месяцев, что является явным недостатком метода. По данным различных авторов, эффективность их не превышает 40% [4, 5].
Криохирургия. Криохирургические средства, такие как жидкий азот, поражают микроциркуляторное русло и вызывают гибель клеток через образование внутриклеточных кристаллов. Обычно 1–3 цикла замораживания-оттаивания по 10–30 секунд достаточно для достижения желательного эффекта. Особое внимание следует уделять кратковременности аппликаций жидкого азота, чтобы избежать появления обратимых гипопигментаций. Следует учитывать, что криотерапия может быть болезненной и вызывать депигментацию. Более перспективным методом является комбинированное воздействие криотерапией и кортикостероидами [15]. Простым и эффективным методом облегчения внутрирубцового введения стероидов является очень легкое криовоздействие, предшествующее введению, — этот шаг вызовет отек ткани и последующее клеточное и коллагеновое разрушение. Жидкий азот наносится на 5–15 секунд, не доводя кожу до замерзания. Такая техника позволяет лучше распределить препарат в келоидной ткани и минимизировать его проникновение в окружающие ткани.
Лазерная терапия. Аргоновый лазер (488 nm) сходен с углекислым лазером, может способствовать сокращению коллагена за счет локального нагрева. Импульсный лазер на красителях (585 nm) вызывает процесс фототермолиза, приводящий к микроваскулярному тромбозу. В начале 1980-х годов авторы отметили, что при применении импульсного лазера на красителях рубцы становятся менее эритематозными, более мягкими и менее гипертрофическими. Лазерная обработка келоида и гипертрофического рубца при использовании углекислого лазера (10,600 nm) может удалять (может рассекать и прижигать) повреждение, создавая сухую хирургическую окружающую среду с минимальной травмой ткани. Когда углекислый лазер используется как мономодель, процент рецидивирования келоида достаточно высокий, поэтому рекомендуется комбинировать лазерную обработку с постоперативным введением стероидов, что значительно снижает уровень рецидивирования.
Лучевая терапия. Использования радиационной терапии для лечения келоидных рубцов остается спорным. В одном ретроспективном исследовании установлено, что применение поверхностной лучевой терапии после резецированния рубцов вызвало рецидивирование у 53% пациентов [18]. Более перспективным считается преоперативная обработка раствором гиалуронидазы рубцов с последующим хирургическим удалением и затем наружное облучение, для снижения вероятности рецидива [6].
Рентгенотерапия (лучи Букки) основана на действии ионизирующего излучения на соединительную ткань, вызывающем отечность и разрушение коллагеновых волокон, фибробластов. Рентгенотерапия назначается до 6 сеансов облучения с интервалом в 6–8 недель при одноразовой дозе до 15000 Р. Действию ионизирующего облучения подвергаются только поверхностные слои кожи (в частности, рубца), а на подлежащие ткани рентгеновская нагрузка незначительна. Противопоказанием к назначению Букки-терапии являются болезни почек, декомпенсация кровообращения, наличие дерматитов и остаточных ран. Идея применения рентгенотерапии очень рациональна, потому что в случае деструкции некоторого количества фибробластов достигается баланс между синтезом и деградацией сложного коллагена вплоть до изменения самой его структуры. Эта идея, в частности, реализована при использовании современной лазерной техники. Общая доза облучения для предотвращения рецидива келоидного рубца составляет от 15 до 20 Гр. Рекомендуют также одноразовое облучение раны в день снятия швов в тех же дозах — 15–20 Гр. Иногда такую процедуру повторяют до 6 раз с интервалами в 1,5–2 месяца.
Иссечение. Желательно избегать хирургического вмешательства, особенно при наличии келоида. Иссечение дает рецидив в 45–100% случаях и должно крайне редко использоваться как отдельная модель терапии. После иссечения необходима длительная противорецидивная терапия. Когда возможно, применяются давящие на рану повязки и белье в раннем послеоперационном периоде. Снижение рецидивов достигается комбинацией иссечения с другими методами, такими как лучевая или рентгенотерапии, введение интерферона или кортикостероидов [10].
После оперативных вмешательств или травм кожи необходимо проводить профилактические мероприятия, снижающие риск возникновения образования келоида или гипертрофических швов. Период активной терапии должен начинаться на 2-й стадии формировании рубца, т. е. на 10–30 сутки после травмы. По мнению авторов, существует пропорциональная зависимость от эффективности терапевтического лечения от возраста рубцов: рубцы старше 6 месяцев хуже поддаются терапии, чем более молодые. Скорее всего, снижение эффективности лечебных мероприятий связано с уменьшением количества сосудов и уплотнением рубцовой ткани, что ухудшает ее трофику [3]. Профилактические методы могут включать: окклюзивные повязки, компрессионную терапию, наружные аппликации или внутрикожное введение глюкокортикостероидов, Контрактубекс, Лонгидазу, иммунотерапию.
При сформировавшемся рубце с длительностью существования до 12 месяцев возможно проводить терапию всеми методами, а при длительно существующем образовании (более 12 месяцев) эффективны только агрессивные методы: введение кортикостероидов в зону поражения, иссечение, лучевая терапия, Букки-терапия, лазерная терапия.
Косметические процедуры, направленные на внешнюю коррекцию дефекта. Наиболее популярные косметологические процедуры (пилинги, мезотерапия, дермабразия) не несут какой-либо терапевтической цели при воздействии на рубцы. Использование этих методов способствует эстетической коррекции небольших рубцов. Важно знать, что гипертрофические рубцы можно подвергать шлифовке только после того, как они придут в спокойное состояние. Для получения удовлетворительных результатов в лечении рубцов со сроком существования более полугода к косметическим процедурам необходимо подключать 1–2 инъекции кортикостероидов (Дипроспана) [2]. Пескоструйная дермабразия (10–15 сеансов с интервалом в 10–14 дней) при обычном курсовом лечении оказывает удовлетворительные результаты, но при проведении двух курсов по 10–15 процедур эффективность лечения возрастает [2]. Оперативная дермабразия гипертрофических рубцов требует повторной операции через полгода. Полная эпитализация гипертрофических рубцов после их глубокой оперативной дермабразии происходит значительно позже эпителизации нормотрофических и гипотрофических рубцов и растягивалась на 3–4 недели, даже при использовании ранозаживляющих мазей [2]. О. С. Озерская (2002) с целью профилактики рецидива рубцов после их дермабразии провела пересадку аутологичных кератиноцитов. Беспрепятственное снятие повязок возможным на 7–8 день, полная эпитализация рубцов наступила в сроки до 14 дней. Таким образом, очевидно значительное ускорение эпитализации при операции дермабразии рубцов с трансплантацией кератиноцитов. Во избежание еще большей гипертрофии и гипер- или депигментации корректировать гипертрофические рубцы агрессивными методами нельзя, а срединные пилинги можно делать только после проведения курса поверхностных пилингов. Что касается келоидных рубцов, то их лучше не подвергать воздействию раздражающих методов, т. к. велика вероятность спровоцировать их дальнейший рост.
Пилинг фруктовыми кислотами. Во время пилинга происходит отшелушивание ороговевших клеток кожи, стимуляция процессов регенерации ее глубокого слоя. Фруктовые кислоты мягко проникают в кожу, не травмируя ее, и стимулируют выработку коллагена и эластина. Благодаря этому повышается упругость кожи, выравнивается рельеф и уменьшается гиперпигментация, что внешне корректирует косметический дефект небольших рубцов.
Химические пилинги. Для небольших, слабо выраженных гипертрофических рубцов химические пилинги лучше провести в два этапа. При этом в ежедневный домашний уход на 21-й день с целью сглаживания рубцовой гипертрофии включают силиконовый дерматологический крем, который создает окклюзионную пленку, защищая кожу от потери влаги, снимает воспаление и эритему, стимулирует репарацию. Параллельно с пилингами можно проводить сеансы мезотерапии с регенерантами и усилителями локальной микроциркуляции. Терапия слабо выраженных гипертрофированных рубцов после курса химических пилингов может быть продолжена топическими препаратами. При выраженных гипертрофических рубцах пилинги проводятся через шесть-восемь месяцев после иссечения патологического рубца или проведенного курса физиотерапии (гальвано-, фонофорез) с гиалуронидазой и гепарином. Курс химических пилингов тоже проводят в два этапа: сначала несколько сеансов мультифруктовых пилингов (гликолевая, салициловая, молочная, лимонная кислоты) один раз в неделю, затем комплексный ретиноловый желтый пилинг. Пилинг выполняют по индивидуальной схеме в соответствии с параметрами рубца и реакцией кожи.
В заключение необходимо отметить, что терапия келоидных и гипертрофических рубцов, при всем многообразии методов лечения, требует строго индивидуального подхода с учетом основных параметров рубца: размеров и длительности его существования.
По вопросам литературы обращайтесь в редакцию.
Ю. А. Галлямова*, доктор медицинских наук З. З. Кардашова** * РМАПО, ** РГНКЦ, Москва
Ключевые слова: гипертрофические рубцы, келоидные рубцы, келоидная болезнь, келоид, келоидообразование, лечение келоида, лечение рубцов, профилактика рубцов.
Опасно ли нагноение и прогноз течения
Абсцесс послеоперационного рубца требует ранней диагностики признаков и своевременного начала консервативной терапии. За короткий промежуток при адекватном лечении убирают гной, подавляют размножение патогенных микроорганизмов. Регенерация тканей в очищенной ране происходит быстро.
Опасность нелеченого абсцесса состоит в проявлении признаков послеоперационных осложнений. Нагноение может перейти во флегмону, свищ. Обе патологии требуют хирургического вмешательства. При запущенном воспалении раны существует высокая вероятность развития сепсиса. Заболевание характеризуется тяжелым состоянием больного, выраженной интоксикацией. Септическая реакция развивается при попадании бактерий и продуктов их жизнедеятельности в кровеносное русло. Патологическая ситуация может закончиться летальным исходом.
Чтобы предупредить появление признаков осложнений, необходимо лечить нагноение на ранних стадиях развития.
Публикации в СМИ
Рана — травма любой части тела (особенно вызванная физическим воздействием), проявляющаяся нарушением целостности кожи и/или слизистой оболочки.
Классификация • По этиологии •• Колотая рана — рана, нанесённая острым предметом с небольшими поперечными размерами (характеризуется узким и длинным раневым каналом) •• Огнестрельная рана — повреждение тканей и органов с нарушением целости их покрова (кожи, слизистой или серозной оболочки), вызванное огнестрельным ранящим снарядом и характеризующееся зоной первичного некроза и изменений, обусловливающих образование в окружающих тканях очагов вторичного некроза •• Операционная (хирургическая) рана — рана, нанесённая при хирургической операции •• Размозжённая рана — рана с обширной зоной первичного травматического некроза, при нанесении которой произошли раздавливание и разрыв тканей •• Рваная рана — рана, возникающая под влиянием перерастяжения тканей •• Резаная рана — рана, нанесённая скользящим движением тонкого острого предмета •• Рубленая рана — рана, возникшая от удара тяжёлым острым предметом; характерна большая глубина, незначительная зона первичного травматического некроза •• Скальпированная рана — рана с полным или частичным отделением обширного лоскута кожи (на волосистой части головы — всех мягких тканей) •• Укушеная рана — рана, нанесённая зубами животного или человека; характерны инфицированность, неровные раздавленные края •• Ушибленная рана — рана от удара тупым предметом с одновременным ушибом окружающих тканей • По патоморфологии •• Асептическая рана — рана, практически не содержащая микроорганизмов •• Бактериально загрязнённая рана — рана, содержащая микроорганизмы, не вызывающие (или ещё не вызвавшие) патологических изменений •• Гнойная рана — рана, характеризующаяся гнойным воспалением стенок и дна её полости •• Гранулирующая рана — рана, полость которой заполняется грануляционной тканью (заживает вторичным натяжением) •• Инфицированная рана — рана, содержащая патогенные микроорганизмы, вызвавшие раневую инфекцию •• Отравленная рана — рана, содержащая яд. Клиническая картина • Боль • Зияние кожного дефекта • Кровотечение. Неотложная помощь: остановка кровотечения, обезболивание, асептическая повязка, иммобилизация.
Лечение • Первичная хирургическая обработка — иссечение некротизированных тканей и краёв раны, наложение швов •• Свежие раны — наложение первичного глухого шва •• При позднем обращении или при наличии инфицирования накладывают вторичный шов после очищения раны • Экстренная профилактика столбняка. Применяют один из следующих препаратов: адсорбированный столбнячный анатоксин (АС-анатоксин), противостолбнячный человеческий иммуноглобулин, противостолбнячную сыворотку. Осложнения • Травматический шок • Кровопотеря • Инфицирование мягких тканей.
МКБ-10. T14.0 Поверхностная травма неуточнённой области
Использующаяся в настоящее время Международная статистическая классификация болезней и проблем 10 пересмотра (МКБ-10) является нормативным документом, обеспечивающим формирование единого статистического контроля над деятельностью медицинских учреждений, проведение оценки эпидемиологической ситуации в стране, и позволяющим осуществлять единство и сопоставимость поступающих медицинских данных [1]. МКБ-10 является одним из важных методических инструментов обработки статистических данных, что крайне необходимо для автоматизации основных планово-нормативных и управленческих работ [2]. К сожалению, данная классификация содержит погрешности, как в структурном оформлении клинических разделов, так и в кодировке ряда заболеваний. Некоторые диагнозы, существующие в ней, звучат несколько абсурдно, имеется путаница размещения отдельных полиэтиологических заболеваний и синдромов в разделах, которые часто расположены в главах, имеющих к данной нозологии весьма опосредованное отношение. Кроме этого, многие нозологические формы, синдромы и симптомы, распространенные в настоящее время, отсутствуют в принятой классификации, что, несомненно, существенно ограничивает практическое применение МКБ-10.
Многообразие различных форм заболеваний усложняет структуру классификации, поэтому последний пересмотр стал значительно большим по объему и сопровождался обширными методическими указаниями, к сожалению, часто без учета клинической практики. В результате часть клинических диагнозов оказалась в пределах неутонченных состояний или состояний недостаточно дифференцированных, а не в рубриках или подрубриках соответствующих разделов классификации.
Ряд сложностей возникает и в отношении топографических классификаций и терминов, используемых в МКБ-10, многие из которых являются неточными, противоречивыми и не соответствуют клинической практике. К сожалению, следует отметить, что в настоящее время МКБ-10 нельзя рекомендовать в качестве образца терминологии и записей клинических диагнозов в истории болезни и других учетных медицинских документах.
Для решения проблемы единой стандартизации медицинских диагнозов и статистического учета, еще в конце 70-х годов прошлого века возникла идея создания «семейства» классификаций болезней и проблем, связанных со здоровьем на базе МКБ, адаптированных под конкретную специальность, с учетом современных достижений медицинской науки.
Опубликованы и рекомендованы ВОЗ варианты классификаций для стоматологов, онкологов, дерматологов, ревматологов и ортопедов, педиатров, психиатров, врачей общей практики. К сожалению, в области андрологии единая классификация до сегодняшнего дня отсутствует [2].
В настоящее время в НИИ урологии разрабатываются печатная и электронная версии подобной классификации для урологии и андрологии, в основе которой лежат трехзначные и четырехзначные коды МКБ-10. Система кодирования урологических и андрологических заболеваний представлена в виде дерева, где каждый подузел уточняет информацию предыдущего узла. При формировании подузла, к основному коду через точку добавляется цифра от нуля до девяти. Предлагаемая система предусматривает также учет локализации патологического процесса, его стадию и/или фазу [3-5].
Создание печатной и электронной версии новой единой клиникостатистической классификации андрологических болезней позволит:
- облегчить сбор данных и улучшить анализ статистического материала по андрологии за счет повышения достоверности статистической информации и уменьшения числа ошибок из-за несоответствия клинических диагнозов с диагнозами МКБ-10;
- обеспечить детальную оценку сложности клинических случаев и конечных результатов лечения при оказании специализированной (в том числе высокотехнологичной) медицинской помощи;
- стандартизировать постановку андрологических диагнозов в медицинских документах и компьютерных информационных системах органов здравоохранения РФ;
- улучшить экономико-статистический анализ оказания медицинской помощи в области андрологии в интересах здравоохранения РФ, отдельных медицинских учреждений и обязательного медицинского страхования (ОМС);
- оптимизировать затраты на диагностику и лечение андрологических заболеваний.
Следует учитывать, что андрологические заболевания, как правило, полиэтиологичны и многие из них не укладываются только в рамки блока «Болезни мужских половых органов». Современная концепция андрологии, безусловно, базируется на междисциплинарном взаимодействии и находится на стыке смежных медицинских дисциплин (урологии, эндокринологии, психиатрии, генетики, неврологии, терапии и т.д.). Поэтому андрологические заболевания разнородны по своей сути и широко представлены в разных разделах МКБ-10 (таблица 1).
Таблица 1. Общая классификация андрологических заболеваний по МКБ-10 и предложения по ее коррекции
| Код по МКБ-10 | Нозология | Коррекция и комментарии |
| 1 | 2 | 3 |
| A54.0 | Гонококковая инфекция нижних отделов мочеполового тракта без абсцедирования периуретральных или придаточных желез | |
| A54.1 | Гонококковая инфекция нижних отделов мочеполового тракта с абсцедированием периуретральных и придаточных желез | |
| A56 | Другие хламидийные болезни, передающиеся половым путем | |
| A56.0 | Хламидийные инфекции нижних отделов мочеполового тракта | |
| A56.1 | Хламидийные инфекции органов малого таза и других мочеполовых органов | |
| A56.2 | Хламидийная инфекция мочеполового тракта неуточненная | |
| A56.8 | Хламидийные инфекции, передающиеся половым путем, другой локализации | |
| A59 | Трихомоноз | |
| A59.0 | Урогенитальный трихомоноз | |
| A60 | Аногенитальная герпетическая вирусная инфекция (herpes simplex) | |
| A60.0 | Герпетические инфекции половых органов и мочеполового тракта | |
| D17.6 | Доброкачественное новообразование жировой ткани семенного канатика | |
| E28.0 | Избыток эстрогенов | Спорный диагноз. Клинического применения у мужчин не имеет. |
| E28.1 | Избыток андрогенов | Спорный диагноз. Не всеми специалистами приняты верхние пределы нормы. |
| E29 | Дисфункция яичек | Спорный диагноз. Клинического применения не имеет. |
| E29.0 | Гиперфункция яичек | Спорный диагноз. Клинического применения не имеет. |
| E29.1 | Гипофункция яичек | Спорный диагноз. Клинического применения не имеет. |
| E29.8 | Другие виды дисфункции яичек | Спорный диагноз. Клинического применения не имеет. |
| E29.9 | Дисфункция яичек неуточненная | Спорный диагноз. Клинического применения не имеет. |
| E89.5 | Гипофункция яичек, возникшая после медицинских процедур | Спорный диагноз. Клинического применения не имеет. |
| F52 | Сексуальная дисфункция, не обусловленная органическими нарушениями или болезнями | Предлагаем данный диагноз редуцировать в связи с его неопределенностью, все случаи эректильной дисфункции относить к пункту N48.4. |
| F52.0 | Отсутствие или потеря сексуального влечения | |
| F52.1 | Отвращение к половым сношениям и отсутствие полового удовольствия | |
| F52.2 | Недостаточность генитальной реакции | Спорный диагноз. Клинического применения у мужчин не имеет. |
| F52.3 | Оргазмическая дисфункция | |
| F52.4 | Преждевременная эякуляция | Коррекция: F52.4: Нарушения эякуляции |
| Коррекция: F52.4.0 Преждевременная эякуляция. | ||
| Коррекция: F52.4.1 Замедленная эякуляция. | ||
| Коррекция: F52.4.2 Ретроградная эякуляция. | ||
| Коррекция: F52.4.3 Анэякуляция. | ||
| F64.0 | Транссексуализм | |
| F64.2 | Расстройство половой идентификации в детском возрасте | |
| F64.8 | Другое расстройство половой идентификации | |
| F64.9 | Расстройство половой идентификации, неуточненное | |
| F65 | Расстройства сексуального предпочтения | |
| F65.6 | Множественные расстройства сексуального предпочтения | |
| F65.8 | Другие расстройства сексуального предпочтения | |
| F65.9 | Расстройство сексуального предпочтения неуточненное | |
| F66 | Психологические и поведенческие расстройства, связанные с половым развитием и ориентацией | |
| F66.0 | Расстройство сексуального созревания | |
| F66.1 | Эгодистоническая половая ориентация | |
| F66.2 | Расстройство сексуальных отношений | Спорный диагноз. Коррекция: сексуальная дисгармония. |
| F66.8 | Другие расстройства психосексуального развития | |
| F66.9 | Расстройство психосексуального развития неуточненное | |
| F68.0 | Преувеличение соматической симптоматики по психологическим причинам | |
| F83 | Смешанные специфические расстройства психологического развития | |
| F84 | Общие расстройства психологического характера | |
| I86.1 | Варикозное расширение вен мошонки (варикоцеле) | |
| Коррекция: I86.1.0 Варикоцеле слева. | ||
| Коррекция: I86.1.1 Варикоцеле справа. | ||
| Коррекция: I86.1.2 Варикоцеле гемодинамический тип 1 (ренотестикулярный тип рефлюкса). | ||
| Коррекция: I86.1.3 Варикоцеле гемодинамический тип 2 (илеотестикулярный тип рефлюкса). | ||
| Коррекция: I86.1.4 Варикоцеле гемодинамический тип 3 (смешанный тип рефлюкса). | ||
| Коррекция: I86.1.5 Двустороннее варикоцеле. | ||
| N34.0 | Уретральный абсцесс | |
| N34.1 | Неспецифический уретрит | |
| N34.2 | Другие уретриты | |
| N35 | Стриктура уретры | |
| N35.0 | Посттравматическая стриктура уретры | |
| N35.1 | Постинфекционная стриктура уретры, не классифицированная в других рубриках | |
| N35.8 | Другая стриктура уретры | |
| N35.9 | Стриктура уретры неуточненная | |
| N36 | Другие болезни уретры | |
| N36.0 | Уретральный свищ | |
| N36.1 | Уретральный дивертикул | |
| Коррекция: N36.2 Стеноз наружного отверстия уретры. | ||
| Коррекция: N36.3 Облитерация уретры. | ||
| N36.8 | Другие уточненные болезни уретры | |
| N36.9 | Болезнь уретры неуточненная | |
| N37* | Поражения уретры при болезнях, классифицированных в других рубриках | |
| N37.0* | Уретрит при болезнях, классифицированных в других рубриках | |
| N37.8* | Другие поражения уретры при болезнях, классифицированных в других рубриках | |
| N39 | Другие болезни мочевыделительной системы | |
| N39.0 | Инфекция мочевыводящих путей без установленной локализации | |
| N39.3 | Непроизвольное мочеиспускание | |
| N39.4 | Другие уточненные виды недержания мочи | |
| N39.8 | Другие уточненные болезни мочевыводящей системы | |
| N39.9 | Расстройство мочевыводящей системы неуточненное | |
| N40 | Доброкачественная гиперплазия предстательной железы | |
| Коррекция: N40.0 С нарушением качества мочеиспускания. | ||
| Коррекция: N40.1 Без нарушения качества мочеиспускания. | ||
| N41.0 | Острый простатит | |
| N41.1 | Хронический простатит | |
| Коррекция: N41.1.0 Хронический бактериальный простатит. | ||
| Коррекция: N41.1.1 Хронический абактериальный простатит. | ||
| Коррекция: N41.1.1.1 Абактериальный ХП с наличием воспаления. | ||
| Коррекция: N41.1.1.2 Абактериальный ХП без признаков воспаления. | ||
| Коррекция: N41.1.2 Асимптоматический хронический простатит. | ||
| N41.2 | Абсцесс предстательной железы | |
| N41.3 | Простатоцистит | Спорный диагноз. Клинического применения не имеет. Предлагаем данный диагноз редуцировать. Коррекция: N41.3 Колликулит. |
| Коррекция: N41.4 Склероз предстательной железы. | ||
| N41.8 | Другие воспалительные болезни предстательной железы и семенных пузырьков | |
| N41.9 | Воспалительная болезнь предстательной железы неуточненная | |
| N42 | Другие болезни предстательной железы | |
| N42.0 | Камни предстательной железы | Спорный диагноз. Клинического применения не имеет. Предлагаем данный диагноз редуцировать. Коррекция: Простая киста предстательной железы. |
| N42.1 | Застой и кровоизлияние в предстательной железе | Спорный диагноз. Клинического применения не имеет. Предлагаем данный диагноз редуцировать. |
| N42.2 | Атрофия предстательной железы | |
| N42.8 | Другие уточненные болезни предстательной железы | |
| N42.9 | Болезнь предстательной железы неуточненная | |
| N43 | Гидроцеле и сперматоцеле | Предлагаем в пункте N43 рассматривать только гидроцеле. |
| N43.0 | Гидроцеле осумкованное | Спорный диагноз. Клинического применения не имеет. Предлагаем данный диагноз редуцировать. Коррекция: Гидроцеле слева. |
| N43.1 | Инфицированное гидроцеле | Коррекция: Гидроцеле справа. |
| N43.2 | Другие формы гидроцеле | Коррекция: Инфицированное гидроцеле. |
| N43.3 | Гидроцеле неуточненное | Коррекция: Неинфицированное гидроцеле. |
| N43.4 | Сперматоцеле | Коррекция: Гидроцеле неуточненное. |
| Коррекция: N43.5 Сперматоцеле. | ||
| N44 | Перекручивание яичка | Коррекция: N44.0 Перекрут яичка. |
| Коррекция: N44.1 Перекрут гидатиды Морганьи. | ||
| N45 | Орхит и эпидидимит | |
| N45.0 | Орхит, эпидидимит и эпидидимоорхит с абсцессом | Коррекция: Односторонний орхит, эпидидимит и эпидидимоорхит с абсцессом. |
| N45.9 | Орхит, эпидидимит и эпидидимоорхит без упоминания об абсцессе | Коррекция: N45.1 Односторонний орхит, эпидидимит и эпидидимоорхит без абсцесса. |
| Коррекция: N45.2 Двусторонний орхит, эпидидимит и эпидидимоорхит с абсцессом. | ||
| Коррекция: N45.3 Двусторонний орхит, эпидидимит и эпидидимоорхит без абсцесса. | ||
| N46 | Мужское бесплодие | В связи с полиэтиологичностью факторов, приводящих к мужскому бесплодию мы предлагаем дифференцировать данные формы в зависимости от причинных факторов. |
| Коррекция: N46.0 Мужское бесплодие, обусловленное нарушением функции на уровне гипоталамуса/гипофиза. | ||
| Коррекция: N46.1 Мужское бесплодие, обусловленное нарушением функции на уровне яичка. | ||
| Коррекция: N46.2 Мужское бесплодие, обусловленное нарушением функции эфферентных семенных путей и дополнительных половых желез. | ||
| Коррекция: N46.3 Мужское бесплодие, обусловленное дефектом семяизвержения. | ||
| Коррекция: N46.4 Мужское бесплодие, обусловленное иммунологическим фактором. | ||
| Коррекция: N46.5 Мужское бесплодие, обусловленное нарушением функции других органовмишеней андрогенов. | ||
| Коррекция: N46.6 Мужское бесплодие, идиопатическая форма. | ||
| АЛЬТЕРНАТИВНАЯ КЛАССИФИКАЦИЯ МУЖСКОГО БЕСПЛОДИЯ | ||
| Коррекция: N46.0 Мужское бесплодие обусловлено повреждающим внешним фактором воздействия. | ||
| Коррекция: N46.1 Мужское бесплодие обусловлено хромосомной патологией. | ||
| Коррекция: N46.2 Мужское бесплодие обусловлено аномалией строения или развития мужских половых органов. | ||
| Коррекция: N46.3 Мужское бесплодие обусловлено эндокринным фактором. | ||
| Коррекция: N46.4 Мужское бесплодие обусловлено инфекционно-воспалительными заболеваниями мужских половых органов. | ||
| Коррекция: N46.5 Мужское бесплодие обусловлено иммунологическим фактором. | ||
| Коррекция: N46.6 Мужское бесплодие обусловлено ятрогенным фактором. | ||
| Коррекция: N46.7 Мужское бесплодие обусловлено изолированной патологией семенной плазмы. | ||
| Коррекция: N46.8 Идиопатическое мужское бесплодие. | ||
| N47 | Избыточная крайняя плоть, фимоз и парафимоз | Коррекция: N47.0 Избыточная крайняя плоть. |
| Коррекция: N47.1 Фимоз. | ||
| Коррекция: N47.2 Парафимоз. | ||
| Коррекция: N47.3 Функциональный парафимоз. | ||
| N48 | Другие болезни полового члена | |
| N48.0 | Лейкоплакия полового члена | |
| N48.1 | Баланопостит | |
| Коррекция: N48.1.0 Баланопостит острый. | ||
| Коррекция: N48.1.1 Баланопостит хронический. | ||
| N48.2 | Другие воспалительные болезни полового члена | |
| Коррекция: N48.2.0 Кавернит. | ||
| Коррекция: N48.2.1Кавернит серозный. | ||
| Коррекция: N48.2.2 Кавернит гнойный. | ||
| Коррекция: N48.2.3Кавернозный фиброз. | ||
| N48.3 | Приапизм | |
| Коррекция: N48.3.0 Приапизм артериальный. | ||
| Коррекция: N48.3.1 Приапизм ишемический. | ||
| Коррекция: N48.3.2 Приапизм ночной перемежающийся. | ||
| N48.4 | Импотенция органического происхождения | Предлагаем внести коррекцию: Психосоматический синдром эректильной дисфункции. |
| Коррекция: N48.4.0 Эректильная дисфункция с преобладанием органического компонента. | ||
| Коррекция: N48.4.1 Эректильная дисфункция с преобладанием психогенного компонента. | ||
| N48.5 | Язва полового члена | |
| N48.6 | Баланит | |
| Коррекция: N48.6.0 Баланит острый. | ||
| Коррекция: N48.6.1 Баланит хронический. | ||
| Коррекция: N48.6.2 Ксеротический облитерирующий баланит. | ||
| N48.8 | Другие уточненные болезни полового члена | |
| Коррекция: N48.8.0 Малый половой член. | ||
| Коррекция: N48.8.1 Эктопия полового члена. | ||
| Коррекция: N48.8.2 Удвоенный половой член. | ||
| Коррекция: N48.8.3 Перепончатый половой член. | ||
| Коррекция: N48.8.4 Ретрактильный половой член. | ||
| Коррекция: N48.8.5 Скрытый половой член. | ||
| Коррекция: N48.8.6 Болезнь Пейрони. | ||
| Коррекция: N48.8.6.0 Болезнь Пейрони в активной стадии. | ||
| Коррекция: N48.8.6.1 Болезнь Пейрони в функциональной стадии. | ||
| N48.9 | Болезнь полового члена неуточненная | |
| N49 | Воспалительные болезни мужских половых органов, не классифицированные в других рубриках | |
| N49.0 | Воспалительные болезни семенного пузырька | Коррекция: Везикулит. |
| Коррекция: N49.0.0 Острый везикулит. | ||
| Коррекция: N49.0.1 Хронический везикулит. | ||
| N49.1 | Воспалительные болезни семенного канатика, влагалищной оболочки и семявыносящего протока | |
| N49.2 | Воспалительные болезни мошонки | |
| Коррекция: N49.3 Гангрена Фурнье. | ||
| N49.8 | Воспалительные болезни других уточненных мужских половых органов | |
| N49.9 | Воспалительные болезни неуточненного мужского полового органа | |
| N50 | Другие болезни мужских половых органов | |
| N50.0 | Атрофия яичка | |
| N50.1 | Сосудистые расстройства мужских половых органов | Спорный диагноз. Клинического значения не имеет. |
| Коррекция: N50.2 Контактный дерматит гениталий. | ||
| N50.8 | Другие уточненные болезни мужских половых органов | |
| N50.9 | Болезнь мужских половых органов неуточненная | |
| N51* | Поражения мужских половых органов при болезнях, классифицированных в других рубриках | |
| N51.0* | Поражения предстательной железы при болезнях, классифицированных в других рубриках | |
| N51.1* | Поражения яичка и его придатков при болезнях, классифицированных в других рубриках | |
| N51.2* | Баланит при болезнях, классифицированных в других рубриках | |
| N51.8* | Другие поражения мужских половых органов при болезнях, классифицированных в других рубриках | |
| N51.8* | Другие поражения мужских половых органов при болезнях, классифицированных в других рубриках | |
| N94.1 | Диспареуния | |
| N99 | Нарушения мочеполовой системы после медицинских процедур, не классифицированных в других рубриках | |
| N99.1 | Послеоперационная стриктура уретры | |
| N99.8 | Другие нарушения мочеполовой системы после медицинских процедур | |
| N99.9 | Нарушение мочеполовой системы после медицинских процедур неуточненное | |
| Q53 | Неопущение яичка | |
| Q53.0 | Эктопическое яичко | |
| Q53.1 | Неопущение яичка одностороннее | |
| Q53.2 | Неопущение яичка двустороннее | |
| Коррекция: Q53.3 Псевдокрипторхизм. | ||
| Q53.9 | Неопущение яичка неуточненное | |
| Q54 | Гипоспадия | |
| Q54.0 | Гипоспадия головки полового члена | |
| Q54.1 | Гипоспадия полового члена | |
| Q54.2 | Гипоспадия члено-мошоночная | |
| Q54.3 | Гипоспадия промежностная | |
| Q54.4 | Врожденное искривление полового члена | |
| Q54.8 | Другая гипоспадия | Коррекция: Гипоспадия без гипоспадии. |
| Q54.9 | Гипоспадия неуточненная | |
| Q55 | Другие врожденные аномалии [пороки развития] мужских половых органов | |
| Q55.0 | Отсутствие и аплазия яичка | |
| Q55.1 | Гипоплазия яичка и мошонки | |
| Q55.2 | Другие врожденные аномалии яичка и мошонки | |
| Коррекция: Q55.2.0 Монорхизм. | ||
| Коррекция: Q55.2.0.0 Монорхизм справа. | ||
| Коррекция: Q55.2.0.1 Монорхизм слева. | ||
| Коррекция: Q55.2.1 Полиорхизм. | ||
| Коррекция: Q55.2.2 Синорхизм. | ||
| Q55.3 | Атрезия семявыносящего протока | |
| Q55.4 | Другие врожденные аномалии семявыносящего протока, придатка яичка, семенного канатика и предстательной железы | |
| Q55.5 | Врожденное отсутствие и аплазия полового члена | |
| Q55.6 | Другие врожденные аномалии полового члена | |
| Q55.8 | Другие уточненные врожденные аномалии мужских половых органов | |
| Q55.9 | Врожденная аномалия мужских половых органов неуточненная | |
| Q56 | Неопределенность пола и псевдогермафродитизм | |
| Q56.0 | Гермафродитизм, не классифицированный в других рубриках | |
| Q56.1 | Мужской псевдогермафродитизм, не классифицированный в других рубриках | |
| Q56.3 | Псевдогермафродитизм неуточненный | |
| Q56.4 | Неопределенность пола неуточненная | |
| Q64 | Другие врожденные аномалии [пороки развития] мочевой системы | |
| Q64.0 | Эписпадия | |
| Коррекция: Q64.0.0 Эписпадия головки. | ||
| Коррекция: Q64.0.1 Эписпадия пенильная. | ||
| Коррекция: Q64.0.2 Эписпадия тотальная. | ||
| Q64.1 | Экстрофия мочевого пузыря | |
| Q64.2 | Врожденные задние уретральные клапаны | |
| Q64.3 | Другие виды атрезии и стеноза уретры и шейки мочевого пузыря | |
| Q64.5 | Врожденное отсутствие мочевого пузыря и мочеиспускательного канала | |
| Q64.7 | Другие врожденные аномалии мочевого пузыря и мочеиспускательного канала | |
| Q64.8 | Другие уточненные врожденные аномалии мочевыделительной системы | |
| Q64.9 | Врожденная аномалия мочевыделительной системы неуточненная | |
| Q89.7 | Множественные врожденные аномалии, не классифицированные в других рубриках | |
| Q89.8 | Другие уточненные врожденные аномалии | |
| Q89.9 | Врожденная аномалия неуточненная | |
| Q92.7 | Триплоидия и полиплоидия | |
| Q95.3 | Сбалансированные половые/аутосомные перестройки у нормального индивида | |
| Q98.0 | Синдром Клайнфелтера, кариотип 47,ХХY | |
| Q98.1 | Синдром Клайнфелтера, мужчина с более чем двумя Х-хромосомами | |
| Q98.2 | Синдром Клайнфелтера, мужчина с 46,ХХ-кариотипом | |
| Q98.3 | Другой мужчина с 46,ХХ-кариотипом | |
| Q98.4 | Синдром Клайнфелтера неуточненый | |
| Q98.5 | Кариотип 47,ХУУ | |
| Q98.6 | Мужчина со структурно измененными половыми хромосомами | |
| Q98.7 | Мужчина с мозаичными половыми хромосомами | |
| Q98.8 | Другие уточненные аномалии половых хромосом, мужской фенотип | |
| Q98.9 | Аномалия половых хромосом, мужской фенотип, неуточненная | |
| Q99 | Другие аномалии хромосом, не классифицированные в других рубриках | |
| Q99.0 | Мозаик [химера] 46,ХХ/46,ХY | |
| Q99.1 | 46,ХХ истинный гермафродит | |
| Q99.2 | Ломкая Х-хромосома | |
| Q99.8 | Другие уточненные хромосомные аномалии | |
| Q99.9 | Хромосомная аномалия неуточненная | |
| R10.2 | Боли в области таза и промежности | |
| R30.9 | Болезненное мочеиспускание, неуточненное | |
| R32 | Недержание мочи неуточненное | |
| R33 | Задержка мочи | |
| R36 | Выделение из уретры | |
| R39 | Другие симптомы и признаки, относящиеся к мочевыделительной системе | |
| R39.1 | Другие трудности, связанные с мочеиспусканием | |
| R39.8 | Другие и неуточненные симптомы и признаки, относящиеся к мочевой системе | |
| R44.8 | Другие и неуточненные симптомы и признаки, относящиеся к общим ощущениям и восприятиям | |
| R45 | Симптомы и признаки, относящиеся к эмоциональному состоянию | |
| R45.0 | Нервозность | |
| R45.1 | Беспокойство и возбуждение | |
| R45.2 | Состояние тревоги в связи с неудачами и несчастьями | |
| R45.3 | Деморализация и апатия | |
| R45.4 | Раздражительность и озлобление | |
| R45.7 | Состояние эмоционального шока и стресса неуточненное | |
| R45.8 | Другие симптомы и признаки, относящиеся к эмоциональному состоянию | |
| R46 | Симптомы и признаки, относящиеся к внешнему виду и поведению | |
| R52.1 | Постоянная некупирующаяся боль | |
| R52.2 | Другая постоянная боль | |
| R52.9 | Боль неуточненная | |
| R53 | Недомогание и утомляемость | |
| R54 | Старость | Спорный диагноз. |
| R62 | Отсутствие ожидаемого нормального физиологического развития | |
| R62.0 | Задержка этапов развития | |
| R62.8 | Другие задержки ожидаемого нормального физиологического развития | |
| R62.9 | Отсутствие ожидаемого нормального физиологического развития неуточненное | |
| S30.2 | Ушиб наружных половых органов | |
| S31.2 | Открытая рана полового члена | |
| S31.3 | Открытая рана мошонки и яичек | |
| S31.5 | Открытая рана других и неуточненных наружных половых органов | |
| S38.0 | Размозжение наружных половых органов | |
| S38.2 | Травматическая ампутация наружных половых органов | |
| T19 | Инородное тело в мочеполовых путях | |
| T19.0 | Инородное тело в мочеиспускательном канале | |
| T19.8 | Инородное тело в другом или нескольких отделах мочеполовых путей | |
| T19.9 | Инородное тело в неуточненной части мочеполовых путей | |
| Z84.2 | В семейном анамнезе другие болезни мочеполовой системы | |
| Z87.4 | В личном анамнезе болезни мочеполовой системы | |
| Z90.7 | Приобретенное отсутствие полового органа (органов) | |
| Z99.8 | Зависимость от других вспомогательных механизмов и устройств | |
В этой сводной таблице приведены те симптомы, синдромы и нозологические формы по МКБ10, с которыми в реальной практике встречается практикующий специалист в области андрологии. При этом, по нашему мнению, некоторые из них уже не отвечают современному пониманию патофизиологических процессов и нуждаются в терминологическом и классификационном уточнении (правая колонка).
Естественно, приведенная классификация нуждается в дополнении и доработке, внесении принципиальных поправок с учетом междисциплинарного взаимодействия. Своей публикацией мы хотели бы вызвать дискуссию среди специалистов в области андрологии, главной целью которой было бы создание единой цельной классификации андрологических заболеваний. Это, несомненно, ценно и удобно и для практикующих врачей, и для органов здравоохранения, и для научных исследований, и для страховых компаний. Мы будем благодарны Вам за комментарии и замечания, которые можно отправить на адрес электронной почты
Ключевые слова: МКБ-10, андрологические заболевания, клинико-статистическая классификация.
Keywords: ICD-10, andrology diseases, clinical and statistical classification.
Литература
- Международная классификация болезней и проблем, связанных со здоровьем. ВОЗ, 1992 г.
- Приказ Минздрава РФ от 27.05.1997 № 170 (ред. от 12.01.1998) «О переходе органов и учреждений здравоохранения Российской Федерации на международную статистическую классификацию болезней и проблем, связанных со здоровьем X пересмотра».
- Сивков А.В., Какорина Е.П., Кешишев Н.Г. Единая клинико-статистическая классификация урологических диагнозов // Материалы XI съезда урологов России. М. 2007. С. 598-599.
- Единая клинико-статистическая классификация мочекаменной болезни / Аполихин О.И., Дзеранов Н.К., Сивков А.В., Какорина Е.П., Кешишев Н.Г. // Урология. 2008. № 6. С. 3-6.
- О создании единой клинико-статистической классификации онкоурологических заболеваний на примере новообразований почки / Аполихин О.И., Сивков А.В., Чернышев Ю.В., Какорина Е.П., Кешишев Н.Г., Жернов А.А. // Экспериментальная и клиническая урология. 2010. №1. С. 23-28.
| Прикрепленный файл | Размер |
| Статья в формате PDF | 414.14 кб |