Современные подходы к лечению папилломавирусной инфекции урогенитального тракта
В последние годы в России, как и во многих странах мира, увеличивается заболеваемость папилломавирусной инфекцией. Проблема ее диагностики и лечения привлекает внимание врачей различных специальностей: дерматологов, гинекологов, урологов, онкологов, патоморфологов, иммунологов, вирусологов. Это объясняется высокой контагиозностью и тенденцией к росту частоты данного заболевания, а также способностью некоторых разновидностей вируса папилломы человека (ВПЧ) инициировать злокачественные процессы. Последнее большей частью касается генитальных проявлений папилломавирусной инфекции.
Папилломавирус человека (ПВЧ) является эпителиотропным и обнаруживается в кожном покрове, слизистой оболочке рта, конъюнктиве, пищеводе, бронхах, прямой кишке.
В литературе имеются сведения о том, что внедрение ПВЧ-инфекции происходит на уровне незрелых клеток эпителия кожи и слизистых оболочек (базальный слой). Результатом этого внедрения является пролиферация клеток, но без продукции вирусных частиц, поскольку пролиферирующие клетки эпителия не способны поддерживать жизненный цикл вирусов. Полная репликация ПВЧ происходит только в высокоспециализированных клетках многослойного плоского эпителия: зернистых, шиповатых клетах кожи, поверхностных эпителиоцитах слизистой шейки матки. В настоящее время описано порядка 100 типов папилломавирусов. Следует отметить их ткане- и видоспецифичность. Различные типы ПВЧ связаны с различными видами поражений. Установлено, что с урогенитальной областью ассоциированы определенные типы ПВЧ. Выделяются разновидности:
- низкого онкологического риска;
- среднего онкологического риска;
- высокого онкологического риска.
Структура вирусного генома
Вирусы папиллом относятся к семейству паповавирусов (Papovaviridae), поражающих крупный рогатый скот, птиц, а также человека и способных инфицировать базальные клетки кожи и плоского эпителия. Папилломавирусы — эта одна из наиболее гетерогенных групп вирусов, критерием дифференциации которой является степень генетического родства вирусов по данным молекулярной гибридизации: она колеблется от 10 до 85%. Диаметр вирусных частиц составляет 55 нм. Вирус не имеет внешней оболочки. Капсид вируса состоит из 72 капсомеров. Детальный анализ молекулы ДНК ВПЧ стал возможен после разработки методики расщепления ДНК с использованием эндонуклеаз и анализа этих фрагментов с помощью гель-электрофореза.
При изучении препаратов, окрашенных по Папаниколау, определен специфический комплекс признаков, характеризующих ядро и цитоплазму эпителиальных клеток (койлоцитарная атипия клеток), обусловленных цитопатическим действием вирусов папиллом.
Специфической клеткой для этой инфекции является койлоцит, представляющий собой оксифилтноокрашенную клетку эпителия с четкими границами и ясно выраженной перинуклеарной зоной просветления и многочисленными вакуолями в цитоплазме.
Термин «койлоцитарная дисплазия» введен H. S. Stegner в 1981 г. Предполагается, что эти изменения являются следствием репродукции вируса, вызывающего нарушение метаболизма клеток, приводящие к их частичному некрозу с образованием баллоноподобных клеток.
Цитологическое исследование очагов, вызванных ПВЧ-инфекцией, показало, что в клеточном материале находятся большей частью безъядерные, или ортокератотические, клетки. Около 20% чешуек содержат ядра — т. наз. «паракератотические клетки».
Следует помнить, что для выявления ПВЧ одной морфологии недостаточно. В этой связи целесообразно использовать метод полимеразной цепной реакции (ПЦР), гибридизацию in situ. В литературе все чаще появляются сообщения об определении ПВЧ-инфекции в моче с помощью ПЦР как альтернативном методе тестирования образцов из шейки матки. Наряду с этим используется гнездовая ПЦР в одной пробирке и типоспецифическая гибридизация нуклеотидов.
Метод ПЦР используется при малосимптомных или асимптомных формах заболевания, вызванного ПВЧ-инфекцией.
Иммунохимическими методами удается выявить антигены ПВЧ в тканях остроконечных кондилом в 71,4% случаев, методом гибридизации — в 96,5% и с помощью ПЦР — в 10% случаев.
Эффективность ДНК-гибридизации не превышает эффективности гистологического исследования, но позволяет выявить пациентов с высокой степенью этой инфекции.
Клиника ПВЧ-инфекции
Клинические проявления ПВЧ-инфекции гениталий очень вариабельны. В настоящее время они подразделяются на остроконечные кондиломы, папиллярные разновидности кондилом (с выраженным экзофитным ростом), а также плоские и инвертированные (внутриэпителиальные) с эндофитным ростом. Последний вариант, известный также под названием «субклиническая ПВЧ-инфекция», наиболее сложен в диагностическом плане, поскольку отсутствуют четкие микроскопические изменения эпителия. В этом случае для определения четких границ поражения требуются специальные скрининговые приемы.
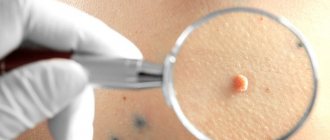
Своеобразным вариантом остроконечных кондилом является бовеноидный папуллез и гигантская кондилома Бушке — Левенштейна. Остроконечные кондиломы (ОК) представляют собой фиброэпителиальное образование на поверхности кожи и слизистых, с тонкой ножкой или широким основанием в виде единичного узелка или множественных эпителиальных выростов, напоминающих по своему виду петушиные гребни или цветную капусту. Диагностика крупных кондилом затруднений не вызывает. Генитальные кондиломы локализуются в основном в местах мацерации: малые половые губы, влагалище, шейка матки, устье уретры, область ануса, кожные покровы. У мужчин ОК располагаются в области крайней плоти, на головке полового члена, перинатальной области, реже эндоуретально. Инкубационный период колеблется от одного до 12 месяцев (в среднем 3-6 месяцев).
Исследования последних десятилетий свидетельствуют о том, что 85% пациенток с типичным ОК вульвы и промежности имеют дополнительные очаги ПВЧ-инфекции во влагалище или шейке матки, и почти у каждой четвертой из них выявляются ассоциированные ПВЧ-инфекцией заболевания — цервикальные интраэпителиальные неоплазии (ЦВН) различной степени тяжести. Одной из клинических разновидностей заболеваний, вызываемых ПВЧ-инфекцией, являются боуэноидные папулы, связанные с ПЧ 16, иногда пигментированные на коже и слизистых оболочках представителей обоих полов, чаще напоминающие обычные бородавки или себорейный кератоз. В противоположность болезни Боуэна, боуэноидные папулы доброкачественные и спонтанно регрессируют, хотя изредка могут озлокачествляться. Течение бессимптомное.
Некоторые авторы к этой группе заболеваний относят верруциформную эпидермодисплазию Левандовского — Лютца. В основе этого заболевания лежат локальные и генетические нарушения, ассоциирующиеся с хронической ПВЧ-инфекцией.
J. M. Handley и W. J. Dinsmore (1994) на основании литературных данных, а также своих собственных исследований предложили классификацию клинических форм ПВЧ-инфекции и ассоциированных с ней заболеваний (табл.1).
В подавляющем большинстве случаев манифестные формы ПВЧ-инфекции сочетаются с другими заболеваниями, передающимися половым путем. По данным Бернарда К. и Муги К. (1996), манифестные формы ПВЧ-инфекции возникают, как правило, в результате действия ряда факторов:
- социальных;
- инфекционных, связанных с ассоциациями заболеваний, передающихся половым путем (ЗППП);
- связанных с изменением иммунного статуса.
Наиболее существенным является влияние ассоциированных с ПВЧ-поражениями инфекций урогенитального тракта: урогенитального хламидиоза, микоплазмоза, цитомегаловирусной и герпетической инфекции, дисбиотических состояний. Результатом их влияния на течение ПВЧ-инфекции является хронизация процесса, формирование стойких, как правило уже неспецифических воспалительных изменений со стороны мочеполовой сферы и значительные трудности в проведении терапевтических мероприятий.
Значимость наличия сопутствующей инфекции для лечения кондиломатоза объясняется следующими обстоятельствами.
- Наличие ЗППП, ассоциированных с ПВЧ-инфекцией, удлиняет срок лечения последних в среднем в три раза.
- В большинстве случаев рецидивы связаны с вышеуказанной причиной.
- Эпителизация эрозий шейки матки после разрушения кондилом может быть достигнута только при наличии предварительного сканирования по поводу сопутствующих ЗППП и бактериального вагиноза.
В течение многих лет обсуждалась возможность существования взаимосвязи между неоплазиями шейки матки с венерическими заболеваниями. В группе женщин, страдающих инвазивным раком шейки матки (РШМ), отмечена более высокая частота выявления неспецифической микрофлоры, включая трихомонадные и гарднереловые инфекции. Примеры такого влияния обсуждались в отношении Treponema pallidum, Neisseria gonorrhoeae, Chlamidia trachomatis, вируса простого герпеса типа 2, цитомегаловируса, вируса папилломы человека. Эпидемиологические исследования убедительно показали, что неоспоримым фактором риска возникновения предраковых изменений и рака шейки матки является генитальная ПВЧ-инфекция.
Принципы лечения ПВЧ-инфекции
Учитывая тот факт, что специфические противовирусные препараты и вакцины, действующие на ПВЧ, пока отсутствуют, принято считать, что полного устранения вируса из организма достичь невозможно. Задача терапии — устранение клинических и субклинических форм ВПЧ-инфекции.
На сегодняшний день в арсенале практикующих врачей имеется множество методов удаления аногенитальных бородавок. Эффективность их варьирует от 30 до 90%, но ни один из методов не является панацеей, так как частота рецидивов достаточно высока при любом способе лечения. Лечение должно быть строго индивидуальным: необходимо подбирать наиболее оптимальное решение в каждом конкретном случае, иногда учитывая пожелания самого пациента. Проблема рецидивов не зависит от выбора терапии. Рецидивы аногенитальных бородавок связаны чаще всего не с реинфекцией от полового партнера, а с реактивацией инфекции. Существуют три пути развития событий при отсутствии лечения:
- бородавки могут разрешаться самостоятельно;
- оставаться без изменений;
- прогрессировать.
При этом всегда нужно принимать во внимание возможность персистенции вируса при отсутствии каких-либо клинических проявлений.
Выбирая наиболее оптимальный в каждом конкретном случае метод, необходимо руководствоваться четырьмя основными характеристиками:
- эффективность при данной патологии;
- частота рецидивов после лечения;
- переносимость (минимум побочных эффектов);
- простота выполнения процедур.
Помимо удаления аногенитальных бородавок необходимо решать следующие немаловажные задачи:
1. Выявлять и лечить у больных с аногенитальными бородавками (и их половых партнеров) другие заболевания, передающиеся половым путем (ЗППП).
2. Проводить скрининг всех женщин с бородавками аногенитальной области на цервикальную внутриэпителиальную неоплазию (ЦВН) с применением цитологического исследования и кольпоскопии.
3. Поддерживать дальнейшее наблюдение за очагами ЦВН на ранних стадиях для своевременного выявления их прогрессирования или развития микроинвазивной карциномы.
4. Проводить активное лечение аногенитальных бородавок, неоплазий на ранних стадиях, протекающих с развернутой клинической картиной, неоплазий на поздних стадиях и плоскоклеточной карциномы.
5. Давать больным рекомендации по использованию презервативов и ограничению случайных половых контактов для предотвращения инфицирования (и реинфицирования) ВПЧ-инфекцией и другими ЗППП.
По сути, лечение аногенитальных ВПЧ-поражений направлено либо на разрушение папилломатозных очагов тем или иным методом, либо на стимуляцию противовирусного иммунного ответа, возможно сочетание этих подходов.
Деструктивные методы
Физические деструктивные методы
Хирургическое иссечение. В настоящее время применяется нечасто, в основном используется при лечении злокачественных новообразований, когда необходимо широкое иссечение. Данный метод может потребовать госпитализации в связи с тем, что при проведении иссечения может возникнуть достаточно сильное кровотечение, а длительный послеоперационный период потребует специальной терапии.
Электрохирургические методы. К ним относят электрокоагуляцию, электроакустику, фульгацию, электрохирургическое иссечение (электроэксцизия) с использованием электроножа. Не так давно в медицине стали использовать плазму. Нашими учеными был разработан оригинальный плазменный коагулятор (плазмаскин) ЭКХ-1, не имеющий зарубежных аналогов. Измерения температуры в плазме показали, что она может достигать 2000-2500°С. Такие высокие значения температуры, в свою очередь, обеспечивают возможность работать в бесконтактном режиме, существенно снижается время операции и тем самым уменьшается зона некроза. Кроме того, при таком воздействии в большинстве случаев не превышается болевой порог. Данный температурный режим обеспечивает практически полное сжигание новообразований.
Достоинства данного метода:
- доступность;
- дешевизна;
- достаточно высокая эффективность;
- возможность применения в амбулаторных условиях;
- снижена опасность кровотечений.
Недостатки:
- необходимость обезболивания
- при использовании данного метода происходит выделение инфекционной ДНК ВПЧ вместе с образующимся дымом, поэтому необходимо создание адекватных условий для работы — вакуум-экстракция дыма, применение защитных масок.
Лазерное иссечение. Достаточно эффективным и безопасным методом является иссечение бородавок с помощью лазера. В практике применяют неодимовый и СО-лазеры. При использовании СО-лазера меньше повреждаются окружающие ткани, а неодимовый лазер дает лучший гемостатический эффект. Помимо того что лазер физически удаляет поражения, исследования показали, что лазерное излучение оказывает на ВПЧ токсическое действие. Для выполнения процедур требуется хорошо обученный персонал. При использовании лазеров необходимо обезболивание — чаще достаточно местной или локальной анестезии, что позволяет проводить процедуры в амбулаторных условиях. Лазерное иссечение и хирургические методы примерно одинаково эффективны. Лазеротерапию можно успешно применять для лечения распространенных, устойчивых к другой терапии кондилом. Она позволяет прекратить рецидивирование примерно у 40% больных. Исследования показали, что столь малоэффективный результат связан с тем, что СО-лазер неэффективен, когда речь идет об устранении генома из поражений, устойчивых к лечению (по данным метода ПЦР, молекулярно-биологическое излечение наступает у 26% больных).
Использование СО-лазера представляет собой метод выбора при лечении ЦВН. Применяют лазерную конизацию шейки матки. Рецидивы наблюдаются у 2% больных. Мягким методом лазеротерапии является вапоризация, не вызывающая практически никаких осложнений. Лазерная вапоризация успешно применяется при лечении ЦВН низкой степени. Рецидивы наблюдаются у 4% больных.
Лазеротерапия успешно используется для лечения остроконечных кандилом у беременных. Имеются сообщения о лечении беременных на 28–35-й неделе беременности. У большинства пациенток излечение наступало после первого сеанса. Каких-либо осложнений в родах или у новорожденных не выявлено.
Из побочных эффектов следует отметить изъязвление, кровотечение, вторичное инфицирование, рубцевание. Как и при использовании электрохирургических методов, происходит выделение ДНК ВПЧ с дымом, что также требует мер предосторожности.
Лазеротерапия не используется достаточно широко в связи с высокой стоимостью оборудования и необходимостью подготовки опытного персонала.
Криотерапия. Достаточно эффективный и безопасный метод, предполагающий использование в качестве хладагента жидкого азота, оксида азота и диоксида углерода. При этом происходит быстрое замораживание как внутри-, так и внеклеточной жидкости, приводящее к лизису и гибели клеток при оттаивании. Проведение криотерапии обычно не требует обезболивания, хотя при необходимости можно использовать местные анестетики. Криотерапию можно применять при лечении не очень больших бородавок различной локализации. Если же бородавки множественные, то удаление должно проводиться в несколько этапов. Для данного метода характерны следующие побочные явления: развитие местного покраснения, припухлости с последующим образованием пузырей и их изъязвлением. Для уменьшения повреждения окружающих тканей перед процедурой поверхность бородавок обрабатывают KY-гелем, который при замораживании дает возможность осторожно приподнять и отделить очаг поражения от подлежащего эпителия.
Метод может быть использован в гинекологической практике.
Чрезвычайно перспективным нам представляется сочетанное применение криодеструкции и плазменной коагуляции, позволяющее избежать недостатков, присущих вышеописанным методам в отдельности.
Химические деструктивные методы. Данная группа средств включает в себя растворы кислот, щелочей, солей. Среди них можно упомянуть ферезол, пероксид водорода, растворы акрихина и хингамина, препараты ртути и мышьяка, висмута, препараты на основе салициловой и молочной кислот, уксусную и азотную кислоты, соки туи и чистотела. Все эти средства легко доступны, однако обладают невысокой, плохо прогнозируемой эффективностью, дают многочисленные побочные эффекты.
Изопринозин следует применять в сочетании с местнодеструктивными методами лечения.
Эффективность комбинированного лечения ИП, по литературным данным, составляет от 38 до 96%.
Комбинированные методы лечения. Для лечения проявлений ПВЧ-инфекции предлагаются различные методики, основанные на использовании иммунных препаратов в сочетании с лазерным, электрохирургическим и криодеструктивным воздействием.
Сочетанное применение вышеуказанных методов позволяет уменьшить число рецидивов и тем самым повысить эффективность лечения.
Получены хорошие результаты при использовании комбинированного метода лечения кондилом, включающего разрушение очагов с помощью криодеструкции (температура воздействия от –160 до –180°С, экспозиция 40–120 с, двукратно) в сочетании со стимуляцией иммунитета. Для стимуляции местного иммунитета область поражения обрабатывали эмульсией, содержащей интерферон (ИФ), а для стимуляции иммунной системы всего организма назначали препарат кемантан по 0,2 г три раза в день внутрь в течение 10 дней.
Возможно сочетание различных деструктивных методов. При наличии проявлений ПВЧ-инфекции на коже и слизистых оболочках предварительно производят криораспыление в течение 10–30 с, позволяющее четко выявить границы поражения за счет характерной сосочковой поверхности поражений, которая при этом белеет. Затем область поражения подвергается воздействию плазмы (с помощью аппарата плазмаскин).
Ряд исследователей лучшим способом лечения аногенитальных бородавок признают хирургическое удаление всех видимых поражений с последующим местным введением ИФ. В некоторых случаях целесообразно общее и местное применение ИФ перед хирургическим иссечением обширных кондилом.
Терапевтический эффект от применения ИФ отсутствует, если заболевание длится более одного года, а также при иммунодефиците.
В настоящее время существует не так много средств, которые можно использовать после применения деструктивных методов. В частности, сейчас появился препарат импран для местного применения в области очагов поражения после деструктивного воздействия.
Специфическая противовирусная терапия
В настоящее время не существует препаратов, оказывающих специфическое действие на ВПЧ. Известные средства, подавляющие репликацию вируса простого герпеса (ацикловир, ганцикловир), оказались неэффективны при лечении аногенитальной ВПЧ-инфекции.
Теоретически вакцинация представляет собой идеальный метод лечения и профилактики аногенитальных бородавок.
Есть сообщения об эффективном применении индукторов ИФ. Представляет интерес местное применение низкомолекулярного производного имиквидахинолинамина — имиквимода, который является индуктором цитокинов и, в частности, Л-ИФ. Его используют в виде 5%-ного крема три раза в неделю либо ежедневно на ночь до полного исчезновения высыпаний (но не более 4 месяцев). Полное исчезновение кондилом наблюдается в 13–56% случаев. При ежедневном применении чаще развивались местные побочные эффекты: покраснение, отечность, эрозии. Крем особенно показан для лечения субклинической ВПЧ-инфекции. Возможно применение виразола.
Эффект от использования монотерапии ИФ все-таки недостаточно изучен и не очень высок, кроме того, необходимо принимать во внимание высокую стоимость такого лечения. В связи с этим данный метод не получил широкого распространения в практике.
Изопринозин. В последние годы пристальное внимание иммунологов привлек новый иммуномодулятор изопринозин, представляющий собой комплекс инозина и соли N,N-диметиламина-2-пропанола и Р-ацетаминобензойной кислоты. Препарат может применяться в виде таблеток либо раствора для парентерального инъецирования. Активным веществом в этом комплексе, по-видимому, является инозин, а соль аминоспирта стимулирует его проникновение через мембрану лимфоцитов и других клеток.
Изопринозин обладает мощным и широким иммуномодулирующим действием. Многочисленные данные и обширная литература свидетельствуют о том, что in vitro препарат существенно усиливает пролиферацию Т-лимфоцитов, индуцированную митогенами или специфическими антигенами, а также дифференцировку пре-Т-лимфоцитов в более зрелые Т-лимфоциты, сопровождающуюся появлением на их поверхности соответствующих антигенов. ИП также стимулирует индуцированную митогеном пролиферацию В-лимфоцитов. Доказано стимулирующее действие изопринолина на активность натуральных киллерных клеток (НК-клеток) у здоровых людей и функциональную способность цитотоксических Т-лимфоцитов. Препарат улучшает соотношение CD4+/CD8+; повышает выработку Т-лимфоцитами ИЛ-2; содействует созреванию и пролиферации Т-клеток; активизирует синтез ИЛ-1 макрофагами. ИП обладает противовирусным действием и препятствует использованию рибосомальной РНК для размножения вируса. Следует отметить, что в случае применения изопринолина с другими иммунокорректорами он существенно усиливал противовирусное действие последних.
Приняты различные схемы лечения с применением изопринолина в зависимости от размеров кондилом, их локализации и степени малигнизации.
Схема 1: лечение мелких, множественных остроконечных кандилом с низкой степенью малигнизации.
Препарат принимают по 2 табл. три раза в день в течение 14–28 дней.
Схема 2: лечение множественных кондилом с отдельными крупными кондиломами или плоской кондиломы шейки матки.
Среди применяемых в нашей стране и за рубежом химических препаратов, оказывающих деструктивное действие, можно выделить ТХУ и азотную кислоту, а также комбинированный кислотный препарат — солкодерм.
ТХУ и азотная кислота. ТХУ применяется в 80-90%-ной концентрации и вызывает образование локального коагуляционного некроза. Аналогичное действие оказывает раствор азотной кислоты. В силу своей дешевизны и доступности оба метода достаточно широко распространены и по сей день. Кислоты эффективны для лечения кондилом вульвы, препуциального мешка, венечной борозды, головки полового члена, особенно в тех случаях, когда противопоказано применение ПФ и ПФГ. Прижигания проводят один раз в неделю в течение 5-6 недель. Эффективность применения ТХУ и азотной кислоты составляет примерно 70-80%. В некоторых случаях может развиться местная реакция в виде мокнутия и изъязвления.
Солкодерм. Солкодерм — водный раствор, в качестве активной составляющей которого выступают продукты взаимодействия органических кислот (уксусной, щавелевой и молочной) и ионов металлов с азотной
кислотой. Раствор содержит нитриты в количестве 0,02 мг/мл.
Ниже перечислены свойства и механизм действия солкодерма, которые выделяют его среди других препаратов этой группы, использующихся в рамках деструктивных методов:
- при местном применении солкодерм вызывает немедленную прижизненную фиксацию ткани, на которую он наносится;
- действие препарата строго ограничивается местом применения;
- признаком немедленного эффекта является изменение окраски обрабатываемого участка;
- девитализированная ткань высыхает и темнеет (эффект мумификации);
- «мумифицированный» струп отторгается самостоятельно;
- процесс заживления непродолжителен, а осложнения (вторичная инфекция или рубцевание) редки.
Общая характеристика лечения солкодермом:
- препарат оказывает точно ограниченное местное действие на патологически измененную ткань, на которую он наносится, окружающая ткань при этом не повреждается;
- метод пригоден для лечения различных новообразований кожи;
- лечение безболезненно;
- быстрое заживление, отсутствие осложнений;
- лечение проводится амбулаторно и не требует специальной аппаратуры;
- отсутствие каких-либо ограничений для больного.
Показания к применению солкодерма: простые бородавки, подошвенные бородавки, аногенитальные бородавки (остроконечные кондиломы), себорейные кератозы, актинокератозы, базально-клеточные эпителиомы (базалиомы).
Солкодерм очень удобен в применении и достаточно эффективен для лечения кондилом любой локализации. В большинстве случаев достаточно однократного применения.
Цитотоксические препараты
Подофиллин (ПФ). Пофиллин — смола, полученная из растений P.pelatum и P.emodi, растущих в Северной Америке и Гималаях. Для лечения бородавок аногенитальной области применяют 10-25%-ный раствор ПФ в этаноле или настойке бензоина. Он связывается с аппаратом микротрубочек клетки и ингибирует митозы, а также подавляет транспорт нуклеиновых кислот, в результате чего происходит ингибирование синтеза ДНК и клеточного деления.
Применение ПФ является простым, доступным, достаточно безопасным методом лечения, который может быть использован в амбулаторных условиях, а также самостоятельно пациентами. Препарат наносят один-два раза в неделю в течение максимум 5 недель в количестве не более 0,5 мл за одну процедуру. Больному необходимо следить, чтобы вода не попадала на обработанное место в течение 4-6 часов после процедуры. ПФ не рекомендуется применять при вагинальных, цервикальных и внутриэпителиальных бородавках. По сведениям ряда авторов, частота рецидивирования варьирует от 0 до 67%.
Примерно у 10-15% больных развиваются местные побочные реакции в виде мокнущего контактного дерматита. Особенно тяжелые осложнения в виде множественных изъязвлений возникают при неправильном самостоятельном применении. В результате длительного или неправильного применения ПФ у больных могут возникать различные побочные реакции, такие как тошнота, рвота, боли в животе, диарея, симптомы поражения почек, миокарда, печени, ЦНС и костного мозга.
Применение ПФ противопоказано при беременности, т. к. были отмечены случаи тератогенного действия на плод и внутриутробной гибели плода.
Многие исследователи считают ПФ недостаточно изученным и грубоочищенным растительным экстрактом, в связи с чем рекомендуют использовать только высокоочищенные подофиллотоксины, причем самостоятельное применение препарата самими больными нежелательно в силу вышеуказанных осложнений.
Подофиллотоксин (ПФТ) (кондилин). ПФТ — наиболее активная в терапевтическом отношении фракция ПФ. Выпускается в виде растворов 0,25, 0,3 и 0,5%, а также в виде крема 0,15, 0,3 и 0,5%.
Обычно его назначают два раза в день в течение трех дней в неделю подряд на протяжении 4-5 недель.
Несмотря на то что ПФТ лучше очищен по сравнению с ПФ, сообщается о большой частоте побочных явлений при использовании ПФТ, особенно его 0,5%-ного раствора. Наиболее часто в результате применения ПФТ наблюдаются следующие побочные эффекты: местные воспалительные реакции (эритема, жжение, болезненность, зуд, мокнутие и эрозии в области аппликации). Хотя в литературе не описано системных побочных эффектов, рекомендуется ограничивать применение ПФТ дозой 0,2 мл за одну процедуру.
Недостатками ПФТ являются его высокая стоимость и большая длительность лечения.
5-фторурацил (5-ФУ). 5-фторурацил (5-ФУ) является антагонистом пиримидина и обладает способностью нарушать синтез как клеточной, так и вирусной ДНК. Для лечения бородавок аногенитальной области его назначают в виде 5%-ного крема. При лечении интравагинальных бородавок препарат назначается один раз на ночь в течение недели или один раз в неделю в течение 10 недель. Степень эффективности препарата, по мнению различных исследователей, составляет 85-90%. При применении 5-ФУ могут возникнуть мокнущие эрозии на слизистой влагалища, вплоть до развития тяжелого мокнущего контактного дерматита. При лечении бородавок терминальной части уретры крем вводится сразу после мочеиспускания на ночь в течение 3-8 дней. Полное излечение внутриуретральных бородавок наблюдается у 90-95% мужчин. Однако при лечении наблюдается множество побочных эффектов: стеноз и стриктуры уретры, дизурия, изъязвления. Препарат противопоказан при беременности.
Иммунологические методы
Интерферон. Поскольку вирус папилломы человека сохраняется в эпителиальных клетках и использование деструктивных методов не гарантирует от рецидивов, перспективным в этом плане является применение ИФ как в качестве монотерапии, так и в сочетании с другими методами лечения.
ИФ являются эндогенными цитокинами, обладающими противовирусными, антипролиферативными и иммуномодулирующими свойствами. Существуют три основных класса ИФ: лейкоцитарный (Л-ИФ), фибробластный (Ф-ИФ) и Т-лимфоцитарный (Т-ИФ). ИФ можно применять местно, внутриочагово и системно (подкожно, в/м или в/в). Установлено, что при использовании ИФ у пациентов в очагах поражения снижается количество вирусной ДНК (по данным ПЦР), что коррелирует с клиническим улучшением или исчезновением поражения.
Имеются данные, касающиеся использования для лечения кондилом отечественного ИФ — человеческого лейкоцитарного интерферона (ЧЛИ). Его применяли внутриочагово (под папиллому) в дозе 100 000-500 000 МЕ, на курс 3-6 процедур в сочетании с нанесением на поражения интерфероновой мази с активностью 40 МЕ. ЧЛИ можно назначать системно и при лечении распространенных поражений в сочетании с деструктивными методами.
Наиболее эффективным препаратом при различных способах, схемах и дозах введения можно считать Л-ИФ. При системном применении Л-ИФ полное исчезновение бородавок наблюдали у 11–100% пациентов. Эффективность применения Ф-ИФ составила 45–82%. Эффективность Т-ИФ, показанная в разных исследованиях, гораздо ниже, чем у Л-ИФ и Ф-ИФ, и варьирует от 7 до 57%.
Следует помнить, что бессистемное использование различных методов лечения приводит к высокому проценту рецидивов, однако разработка определенных алгоритмов, учитывающих пол больных, локализацию и количество высыпаний, позволяет существенно снизить количество рецидивов.
Таблица 1. Аногенитальная ВПЧ-инфекция и ассоциированные с ВПЧ заболевания
ВПЧ-инфекция
Развернутые клинические формы (видимые невооруженным глазом или не видимые, но определяющиеся при наличии соответствующей симптоматики):
- бородавки (остроконечные кондиломы, плоские кондиломы, вульгарные бородавки)
- симптоматические внутриэпителиальные неоплазии на ранних стадиях — койлоцитоз, дискератоз при отсутствии дисплазии (плоские кондиломы)
Субклинические формы (не видимые вооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/или цитологическом или гистологическом исследовании
- бессимптомные внутриэпителиальные неоплазии (ВН) на ранних стадиях — койлоцитоз, дискератоз при отсутствии дисплазии (плоские бородавки)
Латентные формы (отсутствие морфологических или гистологических изменений при обнаружении ДНК ВПЧ)
назад
Таблица 2. Заболевания, ассоциированные с ВПЧ
Клинические и субклинические формы:
- ВН на ранних стадиях — слабовыраженная дисплазия, /+-/ койлоцитоз, дискератоз (ВН 1 стадия)
- ВН на поздних стадиях — выраженная дисплазия, /+-/ койлоцитоз, дискератоз (ВН 2 стадия)
- ВН на поздних стадиях — тяжелая дисплазия или карцинома in situ /+-/ койлоцитоз, дискератоз (ВН 3 стадия, или CIS)
Микроинвазивная сквамозноклеточная карцинома:
- клинически видимые или невидимые, но при наличии соответствующей симптоматики
- субклинические, не видимые невооруженным глазом и бессимптомные, выявляющиеся только при цитологическом и гистологическом исследовании
- латентные — отсутствие морфологических и гистологических изменений при обнаружении ДНК ПВЧ-инфекции методом молекулярной гибридизации
- внутриэпителиальная неоплазия
Таблица 3. Классификация методов лечения аногенитальных бородавок
Деструктивные методы
- физические
- хирургическое иссечение
- электрохирургические методы
- криотерапия
- лазеротерапия
- химические
- азотная кислота
- трихлоруксусная кислота (ТХУ)
- солкодерм
Цитотоксические методы
- подофиллин (ПФ)
- подофиллотоксин (ПФТ)
- 5-фторурацил
Иммунологические методы
- интерфероны
- изопринозин
Комбинированные методы
- сочетанное применение различных методов
Ежедневно человек вступает в контакт с огромным количеством микроорганизмов и вирусов, которые могут вызывать изменения функций систем организма, приводя к различным по тяжести и длительности заболеваниям, а также к неблагоприятным последствиям этих болезней.
Основными этапами взаимодействия вирусов с клеткой хозяина являются адсорбция (взаимодействие специфических рецепторов вируса и клетки хозяина), слияние суперкапсида с мембраной клетки, выделение нуклеиновых кислот нуклеокапсида и активация вирусной нуклеиновой кислоты, синтез нуклеиновых кислот и вирусных белков, сборка вирионов и выход новых вирусных частиц из клеток в межклеточное пространство, кровь или лимфу [1, 2].
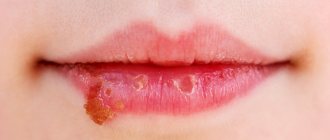
К наиболее распространенным инфекциям относится инфекция, вызванная вирусами простого герпеса (ВПГ), основными особенностями которой по современным представлениям являются глобальный нозоареал распространенности, множество путей и способов передачи вирусов, чрезвычайно высокая инфицированность во всем мире, корреляция серопозитивности с социально-экономическими условиями, существование вирусов в ассоциациях с коинфекциями, высокая естественная восприимчивость людей и ряд других факторов. В Российской Федерации и странах СНГ ежегодно регистрируется около 22 млн случаев рецидивов герпесвирусной инфекции [3].
К группе вирусов, являющихся возбудителями герпетической инфекции, относятся цитомегаловирусы (ЦМВ). Актуальность изучения заболеваний, вызванных этими вирусами, обусловлена неблагоприятными последствиями, которые могут возникать в случае инфицирования в периоде новорожденности или на первом году жизни ребенка, или при первичном заболевании матери во время беременности [4]. По данным статистики, на первом году жизни антитела к цитомегаловирусной инфекции (ЦМВИ) обнаруживаются у 20% детей. У посещающих детские сады детей распространенность инфекции составляет 25—80%, во взрослой популяции антитела к ЦМВ встречаются у 85—90% населения [5].
Источником инфицирования может быть вирусоноситель, больной острой формой (в случае первичного инфицирования) или больной в период обострения инфекции. Пути передачи инфекции: воздушно-капельный, половой, контактный, пероральный, парентеральный, энтеральный и вертикальный, при этом передача вирусов может осуществляться через все биологические жидкости и выделения организма (слюна, моча и др.). При проникновении в организм иммунокомпетентных лиц, после первичного инфицирования, вирус может оставаться в организме пожизненно, в этом случае инфекция протекает бессимптомно (вирусоносительство), так как вирус защищен лимфоцитами от действия специфических антител и интерферона [6].
В современной медицинской литературе латентное течение инфекции, вызванной ЦМВ, обозначается как ЦМВ-инфекция, а клинически выраженное течение с поражением органов — как ЦМВ-болезнь. Развитие ЦМВ-болезни характеризуется лейкоцитарной инфильтрацией различных органов, что косвенно свидетельствует об участии в этом патологическом процессе интерлейкина-8, макрофагального воспалительного протеина-1α (MIP-1α) и других хемокинов и адгезивных молекул [7].
Клинически выраженное заболевание может развиваться при первичном инфицировании, при активации латентной инфекции на фоне снижения резистентности организма, что может наблюдаться у детей, беременных, взрослых со сниженным иммунитетом.
Клиническая картина ЦМВИ неспецифична и во многом зависит от пути инфицирования, состояния иммунной системы. Наиболее типичными симптомами ЦМВ-болезни являются лихорадка выше 38 °C, лейкопения, тромбоцитопения, повышение активности печеночных ферментов [8]. При ЦМВ-болезни могут развиваться поражение желудочно-кишечного тракта, гриппоподобные симптомы, воспалительные процессы носо- и ротоглотки. Наиболее тяжелая форма заболевания — ЦМВ-пневмония, характеризуется развитием тяжелой дыхательной недостаточности нередко с резистентностью к антибиотикам.
Вирусоносительство, проявляющееся стойким обнаружением антител класса G к ЦМВ, наблюдается у 90—95% взрослого населения (ЦМВ-позитивность), при этом вирусоноситель не опасен для окружающих, однако при снижении иммунитета носительство может перейти в активную форму, что вызывает появление антител класса М или многократное повышение уровня антител класса G. Генерализованная форма может возникать у лиц с выраженным иммунодефицитом и проявляться воспалением околоушных и подчелюстных слюнных желез, печеночной ткани, надпочечников, селезенки, суставов и других органов. Проявлениями локализованной формы у женщин может быть цервицит, эндометрит, сальпингоофорит, воспаление слюнных желез, шейных лимфатических узлов, у мужчин может быть бессимптомное носительство или вялотекущий уретрит.
У беременных женщин в 50—85% случаев обнаруживаются антитела к цитомегаловирусам, а у 1—12% беременных может наблюдаться первичное инфицирование, представляющее опасность для плода [5].
Первичная ЦМВИ и реактивация хронического процесса могут вызывать такие осложнения как неразвивающаяся беременность или невынашивание беременности, фетоплацентарная недостаточность, синдром задержки роста плода, многоводие, преждевременная отслойка плаценты и другие. Следует отметить, что при первичном инфицировании риск передачи вируса плоду выше, чем при обострении хронической инфекции, а последствия для плода зависят от срока гестации, при котором произошло первичное заражение или реактивация инфекции [9]. В случае, если первичное инфицирование женщины произошло в первой половине беременности, то у 8—10% детей, рожденных этими матерями, могут возникать клинические проявления в виде гепатоспленомегалии, гепатита, тромбоцитопении, петехиальной сыпи, микроцефалии, ретинита, гипербилирубинемии, гипотрофии, синдрома задержки роста плода, пневмонии и других проявлений [10, 11].
Инфицирование во второй половине беременности может приводить к хронической врожденной ЦМВИ, в тяжелых случаях — к нарушению функции центральной нервной системы, печени, нарушению зрения и слуха. Интранатальное и раннее постнатальное инфицирование, возникающее при вскармливании новорожденных серопозитивными матерями, протекает, как правило, без клинических проявлений и встречается чаще, чем трансплацентарное.
Трудности диагностики ЦМВИ связаны с отсутствием сезонной цикличности заболеваемости, характерных клинических проявлений заболевания, частой распространенностью латентных форм течения инфекционного процесса.
Другая широко распространенная вирусная инфекция — папилломавирусная (ПВИ) является ведущей причиной рака шейки матки, возникновения кондилом, плоскоклеточных неоплазий различной локализации. Распространенность инфекции вируса папилломы человека (ВПЧ) в мире среди женщин в возрасте 15—74 лет с отрицательными результатами цитологических мазков варьирует в зависимости от региона и составляет от 5 до 40%. Наиболее широко инфекция распространена среди сексуально активных подростков и женщин молодого возраста; 85% женщин в течение своей жизни инфицируются вирусом [12].
В литературе описано более 200 типов папилломавируса, которые являются строгими эпителиотропами, поражающими эпителий кожи и слизистых оболочек гениталий и других органов (гортань, ротовая полость, глаза и др.) [13].
ВПЧ подразделяют на две группы: ВПЧ низкого и высокого онкогенного риска. Высокоонкогенные типы ВПЧ ассоциированы в первую очередь с плоскоклеточными интраэпителиальными поражениями аногенитальной области (шейки матки — CIN, вульвы — VIN, влагалища — VaIN, ануса — AIN). ВПЧ является причиной рака шейки матки в 91—99,7%, рака вульвы (69%), влагалища (75%), полового члена (63%), предстательной железы, яичника — в 10—30%, рака гортани и ротовой полости — в 10—30% случаев [10].
Способность к неограниченно долгому персистированию ВПЧ в организме больного обусловлена особенностями жизненной стратегии этих вирусов, основанной на блокировании механизмов врожденного и адаптивного антивирусного иммунитета [11]. Механизм развития рака связывают с интеграцией вирусного генома в хромосомы клеток хозяина и длительной его персистенцией [13].
Противовирусная защита организма хозяина — очень сложный и многокомпонентный механизм. Отличительным свойством вирусов в целом, ЦМВ и ВПЧ в частности, является то, что они не могут самостоятельно размножаться, но способны эффективно репродуцироваться в чувствительных клетках макроорганизма, где реализуют свою генетическую программу по созданию потомства [14—16]. При первичном взаимодействии с вирусами инфекционным агентам противостоят неспецифические защитные механизмы организма, к которым относятся эпителий кожи, слизистые оболочки. После проникновения вируса внутрь клетки основную роль в обеспечении местного иммунитета играют интерфероны, другие цитокины, вырабатываемые зараженными клетками, а также лимфоциты, макрофаги, обеспечивающие фагоцитоз и разрушение вирусов. Образующиеся при вирусных инфекциях антитела действуют непосредственно на вирусы или на клетки, инфицированные ими [17].
Практически все вирусы индуцируют выработку интерферонов, их образование является одной из наиболее ранних защитных реакций организма на внедрение вирусов; интерфероны способны подавлять внутриклеточные этапы репродукции вирусов в зараженных клетках, обеспечивать невосприимчивость к вирусам окружающих здоровых клеток и предотвращать диссеминацию вирусов в организме. Поэтому применение иммунотропных препаратов, интерферона и его индукторов становится необходимой частью общепринятого патогенетического лечения различных инфекционных заболеваний [18].
Основным методом диагностики ЦМВ является серологический с выявлением специфических антител к антигенам вируса. Для выявления особенностей течения инфекции рекомендуется определение авидности иммуноглобулинов классов M и G и антител к вирусному белку. Молекулярно-биологические методы (ДНК-гибридизация, лигандная цепная реакция, полимеразная цепная реакция) при диагностике ЦМВИ, ПВИ и других инфекций позволяют выявлять ранние стадии, латентную и персистентную инфекцию, количественные параметры возбудителей. Цитологический метод применяется для проведения экспресс-диагностики ЦМВИ на поверхности хориона, плодных оболочек.
Лечение
. Этиотропные препараты для лечения пациентов с вирусными (цитомегаловирусной, герпесвирусной, папилломавирусной и др.) инфекциями отсутствуют. При лечении больных с тяжелыми, генерализованными формами ЦМВИ возможно применение препаратов, обладающих противовирусным действием (ацикловир, ганцикловир, валацикловир, фамцикловир, фоскарнет и др.), которые прямо или опосредованно ингибируют вирусную ДНК-полимеразу, снижают вирусную продукцию у пациенток с клиническими симптомами, характерными для герпесвирусных инфекций. Однако эти агенты весьма токсичны, и требуется строгий контроль, особенно при длительном применении, за содержанием препарата в крови. Как правило, эти препараты назначают пациенткам после трансплантации или при выраженном снижении иммунитета [19, 20].
Токсичность препаратов в значительной степени ограничивает их применение. Препараты противопоказаны беременным, кормящим матерям и новорожденным, а также не рекомендуются женщинам, планирующим беременность.
Пациенткам с активной инфекцией в прегравидарный период с целью профилактики и лечения внутриутробной инфекции, а также лечения генерализованных форм возможно проведение профилактического лечения, позволяющего обеспечить в подавляющем большинстве случаев наступление беременности и благоприятное ее течение. С этой целью в прегравидарный период показано применение растительных противовирусных препаратов, рекомбинантного интерферона α-2, иммуноглобулина нормального человеческого и др. [21, 22].
В настоящее время весьма перспективным является препарат растительного происхождения, основным действующим компонентом которого служит очищенный экстракт побегов растения Solanum tuberosum
, оказывающий противовирусное действие. На основе этого экстракта создан препарат Панавир, представляющий собой полисахарид, относящийся к классу гексозных гликозидов. Панавир способен повышать неспецифическую резистентность организма к инфекциям и индукцию интерферона, приводить к стабилизации показатели тканевого и гуморального иммунитета, что чрезвычайно важно для женщин, планирующих беременность.
Формы выпуска Панавира: раствор для внутривенных инъекций, ректальные и вагинальные суппозитории, гель для наружного применения и гель-спрей Панавир-Интим и Панавир-Инлайт. Панавир показал свою эффективность в лечении больных с папилломавирусной [23], цитомегаловирусной и герпетической инфекциями [24—26], вирусным гапатитом С [27], клещевым энцефалитом [28] и рядом других заболеваний.
Лечение пациенток с экзофитными кондиломами, хирургическое лечение при кондиломатозных высыпаниях (криодеструкция, радиоволновая хирургия, медикаментозная коагуляция, лазерная вапоризация), особенно проводимое в целях подготовки к беременности, можно комбинировать с местным лечением Панавиром. При этом обработка кондилом гелем Панавир, вагинальное орошение спреем или применение вагинальных (ректальных) суппозиториев способствуют более быстрому заживлению кожных рубцов, уменьшению частоты рецидивов, что важно для женщин, планирующих беременность. Экзофитные формы папилломавирусной инфекции могут возникать на фоне герпетических высыпаний или у женщин-носительниц ВПГ при хламидийной или других инфекциях. Перед назначением лечения рекомендуется проведение предварительного обследования женщин, а в случае выявления инфекций — проведение этиотропной терапии с последующим восстановлением микробиоценоза влагалища, что улучшает результаты лечения. По данным Г.Г. Анташян [23], при комплексном лечении больных с экзофитными формами ПВИ отмечается достоверное снижение частоты проведения деструктивных процедур, а также увеличение межрецидивных интервалов.
Обоснованным является применение Панавира при лечении пациенток с герпетическими поражениями кожи и слизистых оболочек, а также вирусоносительства. При лечении пациентов с рецидивирующим генитальным герпесом выявлено достоверное иммунокорригирующее и противовоспалительное действие препарата, увеличение длительности периодов ремиссии, что свидетельствует об эффективности Панавира [29—31]. Проведение лечения в период планирования беременности позволит снизить риск обострения инфекции в гестационный период.
Проведенные исследования показали хорошую переносимость препарата. Клинические испытания показали отсутствие мутагенного, тератогенного, канцерогенного, аллергизирующего и эмбриотоксического действия препарата при наличии слабого цитотоксического и антипролиферативного эффектов [32]. Назначение Панавира возможно в период прегравидарной подготовки, во II и III триместрах беременности в случае первичной инфекции или реактивации инфекционного процесса.
Для лечения пациенток с заболеваниями, вызванными вирусами, могут быть рекомендованы парентеральные формы Панавира, при этом терапевтическая доза препарата составляет 200 мкг действующего вещества. Кратность внутривенного введения и длительность лечения зависят от возбудителя заболевания. В случае подготовки к беременности, лечения цитомегаловирусной и папилломавирусной инфекций раствор Панавира применяют трехкратно в течение 1-й недели с интервалом 48 ч и двукратно в течение 2-й недели с интервалом 72 ч внутривенно медленно струйно. Возможно также применение Панавира в форме ректальных суппозиториев ежедневно на ночь в течение 10 дней с возможным повтором курса лечения через 1 мес.
Возможно интравагинальное введение суппозиториев при лечении больных с ПВИ-ассоциированной патологией шейки матки или ВПГ-инфицированием, при этом рекомендуемая длительность лечения также составляет 10 дней. Для лечения больных с экзофитными кондилломами рекомендуется нанесение геля Панавир тонким слоем на пораженные участки кожи и/или слизистых оболочек 5 раз в сутки. Продолжительность лечения составляет 4—5 дней, при необходимости курс лечения может быть продлен до 10 дней.
М.М. Дамиров и соавт. [33] показали высокую эффективность комплексного лечения пациенток с плоскоклеточными интраэпителиальными поражениями шейки матки низкой степени выраженности на фоне персистирующей ВПЧ-инфекции 0,004% раствором Панавира по схеме: 5 мл раствора внутривенно медленно курсом в 5 инъекций с и нтервалом 48 ч между первым и вторым введениями с последующим интервалом в 72 ч при одновременном местном применении препарата Панавир-Интим в форме геля интравагинально 2 раза в день в течение 10 дней с экспозицией 10—15 мин после введения препарата.
В 2012 г. проведено открытое рандомизированное сравнительное многоцентровое контролируемое клиническое исследование по изучению безопасности, переносимости и терапевтической эффективности раствора панавира для внутривенного введения 0,04 мг/мл в комплексной терапии беременных с хронической цитомегаловирусной инфекцией в стадии обострения во II и III триместрах беременности [34].
Цель исследования — провести оценку безопасности, переносимости и эффективности Панавира для внутривенного введения в составе комплексной терапии цитомегаловирусной инфекции у беременных во II и III триместре. Было выявлено, что терапия ЦМВ-инфекции Панавиром способствовала эрадикации вирусов, при этом ЦМВ серологическим методом не был обнаружен у женщин, получавших лечение, а также вирусная инфекция не оказала неблагоприятного влияния на течение беременности, развитие плодов и здоровье новорожденных.
Обобщение результатов проведенных исследований позволяет сделать заключение о перспективности дальнейшего изучения терапевтических свойств препарата Панавир в отношении вирусных инфекций, они убедительно доказали, что противовирусный препарат Панавир является эффективным средством при лечении больных с ЦМВИ, ВПЧ, ВПГ, клещевым энцефалитом, может применяться в период прегравидарной подготовки женщин группы высокого риска активизации этих инфекций во время беременности. Препарат показан в случае подготовки к беременности женщин с отягощенным анамнезом, при персистенции папилломавирусной инфекции, хронической, недавно перенесенной острой или с обострением других вирусных инфекций, а также женщинам, у которых диагностировано нарушение интерферонового статуса.
Поиск натуральных природных фармакологических агентов и анализ механизмов их действия является весьма актуальным аспектом в вопросе создания нового поколения противовирусных лекарственных препаратов с целью лечения инфекций человека.