Регистрационный номер: Р N001049/03 Торговое наименование: ЦИКЛОФЕРОН® Группировочное наименование: Меглюмина акридонацетат Лекарственная форма: раствор для внутривенного и внутримышечного введения
Состав препарата Фармакологические свойства Показания к применению Противопоказания
Способ применения и дозы Побочные действия Взаимодействие с другими лекарственными препаратами
Фармакологические свойства
Фармакодинамика
ЦИКЛОФЕРОН® является низкомолекулярным индуктором интерферона, что определяет широкий спектр его биологической активности (противовирусной, иммуномодулирующей, противовоспалительной и др.). Основными клетками-продуцентами интерферона после введения препарата ЦИКЛОФЕРОН® являются макрофаги, Т- и В-лимфоциты. В зависимости от типа инфекции имеет место преобладание активности того или иного звена иммунитета. Препарат индуцирует высокие титры интерферона в органах и тканях, содержащих лимфоидные элементы (селезёнка, печень, лёгкие), активирует стволовые клетки костного мозга, стимулируя образование гранулоцитов. ЦИКЛОФЕРОН® активирует Т-лимфоциты и естественные киллерные клетки, нормализует баланс между субпопуляциями Т-хелперов и Т-супрессоров. Усиливает активность α-интерферонов. ЦИКЛОФЕРОН® демонстрирует противовирусную активность в отношении возбудителей клещевого энцефалита, гриппа, герпеса, цитомегаловируса, вируса папилломы и других вирусов. В доклинических исследованиях показано, что применение Циклоферона на ранних стадиях инфекционного процесса приводит к снижению вирусной нагрузки (титра вируса) в тканях лёгких. Повышает неспецифическую резистентность организма в отношении вирусных и бактериальных инфекций. Установлена высокая эффективность препарата в комплексной терапии острых и хронических бактериальных инфекций (нейроинфекции, хламидиозы) в качестве компонента иммунотерапии.
Фармакокинетика
При введении максимально допустимой дозы максимальная концентрация в крови достигается через 1–2 часа, через 24 часа препарат обнаруживается в следовых количествах. Преодолевает гематоэнцефалический барьер. Период полувыведения составляет 4–5 часов. ЦИКЛОФЕРОН® не обладает кумулятивными свойствами. Не накапливается в тканях при длительном применении.
Опыт применения циклоферона в терапии папилломавирусной инфекции
Исаков В.А., Ермоленко Д.К., Гончаров С.Б., Ермоленко К.Д.
Поражения кожи и слизистых, обусловленные вирусами папилломы человека (ВПЧ), известны человечеству давно. По нуклеотидной последовательности и антигенным свойствам капсидов различают более 130 типов ВПЧ. Геном ВПЧ содержит ДНК. ВПЧ обладают видовой и тканевой специфичностью. Они способны инфицировать клетки плоского эпителия и проявлять внутри них репликативную активность, обнаруживаются на коже, слизистых оболочках полости рта, конъюнктивы, пищевода, бронхов, гортани, прямой кишки, в половых органах [14].
В конце ХХ в. отмечено беспрецедентное распространение ВПЧ–инфекции: считают, что ВПЧ инфицировано примерно три четверти сексуально активных взрослых во всем мире на разных этапах их жизни. В целом в настоящий момент инфицированность ВПЧ лиц биологически активного возраста составляет 20–60% [14]. Инфекция передается преимущественно половым путем, при медицинских манипуляциях (возможно заражение медицинского персонала), вертикальным путем, во время беременности и родов. Инкубационный период составляет 1–6 мес., максимальное содержание вируса в пораженных тканях обнаруживается на 6–й месяц. Нередко результатом инфекции являются заболевания аногенитальной области: рак шейки матки, вульвы, влагалища, перианальной области и генитальные кондиломы. Рак шейки матки – второе по частоте злокачественное заболевание у женщин: ежегодно в мире регистрируеются более 500 тыс. случаев. По прогнозам ВОЗ, число случаев смерти от рака шейки матки увеличится до 320 тыс. в 2015 г. и до 435 тыс. в 2030 г. [12]. Средний возраст больных карциномой in situ – 29 лет, т.е. проходит примерно 10 лет от момента первоначальной инфекции до появления тяжелой неоплазии. Инвазивный рак регистрируется в возрасте 49 лет, когда возникают дополнительные изменения в иммунитете, влекущие за собой инвазию и метастазирование [14,15]. Папилломавирусы – единственная группа вирусов, для которых доказано, что они индуцируют образование опухолей у человека в естественных условиях. Неблагоприятна сочетанная персистенция ВПЧ с вирусом простого герпеса – 2, цитомегаловирусом, вирусом Эпштейна–Барра, вирусом иммунодефицита человека, хламидиями и микоплазмами.
До 20 млн американских граждан болеют генитальными бородавками, причем ВПЧ встречаются в 3 раза чаще, чем генитальный герпес, и не реже, чем гонорея [5]. По данным МЗ РФ (2001), частота наиболее распространенной клинической формы ВПЧ – остроконечных кондилом составляет 26 на 100 тыс. населения, в США – 100 на 100 тыс. населения.
Существенной особенностью ВПЧ является их возможность переключаться с инфекции непродуктивного типа к инфекции продуктивного типа и наоборот. В первом случае вирус реплицируется синхронно с клеткой и не приносит ей вреда. Во втором случае он быстро размножается и лизирует клетку, высвобождая массу новых вирионов, способных инфицировать другие клетки [14]. Показано, что ВПЧ могут оказывать различное действие на слизистую. Так, проявлением продуктивного воздействия являются папилломы и кондиломы, а результатом трансформирующего действия могут быть внутриэпителиальные поражения (дисплазия, инвазивный рак). Таким образом, условиями формирования необратимой неоплазии являются [9]: активная экспрессия генов Е6 и Е7 ВПЧ; индукция метаболических механизмов конверсии эстрадиола в 16a–гидроксистерон, который относится к категории «агрессивных гормонов», вызывающих длительный эффект; индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
ВПЧ–1 – ВПЧ–4 типов были выделены из многослойного плоского эпителия. Они ассоциируются с развитием вульгарных и плоских бородавок рук, а также подошвенных бородавок. С ВПЧ–6, 11, 13, 30–го типов связано в большинстве случаев развитие веррукозного ларингита (ювенильный папилломатоз гортани). Заболевание диагностируется чаще у детей до 5 лет, заразившихся перинатально, и характеризуется появлением папилломатозных разрастаний на голосовых связках, что и приводит к речевым затруднениям, нарушениям циркуляции воздуха в верхних отделах дыхательных путей. ВПЧ были выделены также и на слизистых оболочках полости рта. Описаны случаи ларингеального папилломатоза у детей, рожденных с применением кесарева сечения, поэтому кесарево сечение не должно производиться с единственной целью предупредить заражение новорожденного ВПЧ.
Как было показано выше, ВПЧ–6, 11 могут вызывать рак гортани и глотки, в то же время роль других типов ВПЧ в злокачественном перерождении слизистой ротовой полости изучена недостаточно. Отмечены редкие случаи развития орофарингеальных бородавок, обусловленные «генитальными» серотипами» ВПЧ–16, 18. Наличие одинаковых типов вирусов при различных локализациях поражения слизистой позволяет предположить единый источник инфицирования и способность вирусов взаимодействовать с различными рецепторами на эпителии ротовой полости и урогенитального тракта.
Нами были обследованы 40 женщин детородного возраста, практикующих коммерческий орально–генитальный секс. Взятие материала (соскоб с измененных участков слизистых) осуществляли у пациенток с клиническими проявлениями ВПЧ–инфекции. В дальнейшем все пробы подвергались генетическому анализу при помощи полимеразной цепной реакции (ПЦР) с праймерами, направленными на выявление следующих типов ВПЧ: 16, 18, 31, 33, 50, 59 [3]. ВПЧ–16 выделен в 52,5%, а ВПЧ–18 – в 27,5% случаев. Значительно реже (7,5%) в пробах выявлены ВПЧ–31, 50, 59. ВПЧ–33 были обнаружены только у двух женщин. Следует отметить, что у 6 пациенток регистрировалось несколько серотипов вируса одновременно. Так, в 2 пробах были выделены ВПЧ–16 и 18, в 3 пробах – ВПЧ–16 и 50, в 1 пробе – ВПЧ–16, 31 и 39. Проведенные исследования указывают на существенную роль орально–генитальных контактов в распространении папилломавирусной инфекции, в том числе вирусов высокого онкогенного риска, а также могут косвенно свидетельствовать о повышении риска развития злокачественных заболеваний полости рта и гортани у женщин, использующих орально–генитальные контакты [3].
По мнению Козловой В.И. и соавт. (2003) [10], наиболее часто урогенитальный тракт поражают ВПЧ–6, 11, 16, 18, 31, 35. На основании способности ВПЧ индуцировать неопластические процессы их принято подразделять на разновидности низкого (типы 3, 6, 11, 13, 32, 34, 40, 41, 42, 43, 44, 51, 61, 72, 73), среднего (30, 35, 45, 52, 53, 56, 58) и высокого (16, 18, 31, 33, 39, 50, 59, 64, 68, 70) онкологического риска [9,10]. В последнее время с раком цервикального канала шейки матки (95%) связывают около 20 типов ВПЧ. Среди них наиболее часто выявлются ВПЧ–16 (50%) и ВПЧ–18 (10%), в связи с чем женщины с подтвержденной ВПЧ–инфекцией должны ежегодно проходить осмотр у гинеколога с кольпоскопией, цитологическим исследованием цервикальных мазков, вирусологическое и иммунологическое обследование. Считают, что в 50% случаев папилломавирусной инфекции (ПВИ) вирус выводится из организма женщины в течение 1 года, а в 85% случаев – в течение 4 лет. В Санкт–Петербурге с 1999 по 2004 г. от 28 до 34% женской популяции в возрасте от 20 до 60 лет инфицированы ВПЧ и высокого (ВПЧ 16 и 18 типов) онкологического риска [11]. ВПЧ способствует развитию рака шейки матки в 99,7%, рака вульвы, влагалища, полового члена, предстательной железы, яичка – в 10–30%, рака гортани и ротовой полости – в 10–30% случаев.
Помимо ВПЧ, в развитии онкогенной трансформации определяющую роль играет целый ряд сопуствующих факторов. Прежде всего следует выделить сопутствующие инфекционные заболевания аногенитальной области, возбудители которых нередко выделяются у больных с ВПЧ–инфекцией: хламидии – 62,1%, гонококки – 23,3%, уреаплазмы – 16,2%, вирусы герпеса – 16%, трихомонады – 14,8%. Сочетание ВПЧ–инфекции с двумя инфекциями выявлено в 23,3%, с тремя – в 16,2%, с четырьмя – в 8,1% случаев [2,8]. Большое значение в развитии рака на фоне ПВИ имеют социальный статус и условия жизни, соответствие гормонального фона возрасту, гинекологический анамнез (факторы риска: раннее начало половой жизни, частая смена половых партнеров, травмы цервикального канала, число беременностей и родов, аногенитальные контакты). Важной особенностью ВПЧ–инфекции является полиморфизм, многоочаговость поражения кожи и слизистых оболочек генитального тракта в виде клинической, субклинической и латентной форм [2,6,7].
В Санкт–Петербурге предложена система профилактических мероприятий, направленных на снижение заболеваемости населения вирусозависимыми злокачественными новообразованиями. Комплексная программа обследования включает цитологические методы, обследование на вирусы (ВПЧ, ЦМВ, ВЭБ, вирусные гепатиты В и С). Обнаружение вирусов высокого онкологического риска (ВПЧ–16, 18 типов) обязывает дополнить обследование уточняющими методами диагностики: определение уровня пролактина, пролактин/ТТГ в крови, генное тестирование ВПЧ (соотношение генов Е2–Е6), составление карты генетического риска пациента, что позволит предложить индивидуальную модель стратегии и тактики лечения и наблюдения пациента, а также сформировать группы риска вирусозависимых опухолей [11].
Принципы комплексного лечения ВПЧ–инфекции. При ПВИ, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния (ИДС), обусловленные недостаточностью различных звеньев иммунной системы: отмечается снижение показателей Т–клеточного звена иммунитета, иммунорегуляторного индекса (CD4/CD8), количества клеток Лангерганса и иммунного ответа цервикальных лимфоцитов. Снижена функциональная активность натуральных киллеров (NK), уровень основных сывороточных иммуноглобулинов. Содержание ЦИК в периферической крови увеличено, что коррелировало с распространенностью и тяжестью процесса [7,12,13].
В связи с дисбалансом иммунной системы для более успешного лечения в схемы инфекции, вызванной ВПЧ, необходимо включать, кроме противовирусных (системно и местно), и иммунокорригирующие препараты, а также патогенетические средства (системная энзимотерапия, антиоксиданты, про– и пребиотики), которые облегчают состояние пациента и способствуют более эффективному применению используемых лекарств. При сочетании ПВИ с другими вобудителями проводится комплексное лечение с использованием этиотропных препаратов в отношении конкретных возбудителей в стандартных дозировках. Показано, что современное лечение не позволяет избежать рецидивирования ПВИ в 20–30% случаев [1,2].
Предполагается, что чувствительность ВПЧ к отдельным химиопрепаратам обусловлена прежде всего генетически запрограммированными особенностями иммунного ответа при этой патологии. В процессе эволюции сложился механизм, при котором вирусная инфекция на молекулярном уровне защищается от системного воздействия иммунитета хозяина. В ряде случаев причиной неудач терапии инфекции, вызванной ВПЧ, является применение препаратов интерферона (ИФН), так как онкобелок Е7 вызывает устойчивость зараженных клеток в процессе лечения к препаратам ИФН [1,12].
Таким образом, лечение ПВИ остается довольно трудной задачей, несмотря на значительный арсенал средств и методов терапии. Поскольку полного излечения к настоящему времени достичь невозможно, считается, что целью проводимых лечебных манипуляций должна быть не элиминация возбудителя, а перевод инфекции в стадию устойчивой ремиссии (клинического выздоровления). В связи с этим предлагается следующая тактика ведения пациентов с ВПЧ–инфекцией: 1) разрушение папилломатозных очагов; 2) стимуляция противовирусного иммунитета, т.е. коррекция общего и местного иммунитета; 3) сочетание этих подходов, устранение факторов, способствующих рецидивам болезни [7,12,13].
Локальная деструкция очагов при клиническом и субклиническом течении ВПЧ–инфекции (направленная на удаление поверхностного слоя эпидермиса без санации клеток базального слоя) позволяет излечить только участок эпителия, где произошла манифестация инфекции. В окружающих тканях остается резервуар ВПЧ в неактивном состоянии или недиагностированной субклинической форме, который может быть причиной рецидивов болезни. В ходе пятилетнего наблюдения за пациентками с инфекционным поражением шейки матки, которое обусловлено ВПЧ, отмечена прогрессия латентной стадии папилломавирусной инфекции в клиническую или субклиническую форму в 21,4% случаев. Причем клиническая манифестация инфекции происходит у женщин с персистенцией ВПЧ на фоне дисбаланса показателей иммунитета. Адекватная иммунотерапия способствует подавлению активности ВПЧ и его полной элиминации, снижая частоту рецидивов и риска развития предраковых заболеваний и рака шейки матки у пациенток с латентной ВПЧ–инфекцией [4,6,12]. При остроконечных кондиломах проводится лечение обоих половых партнеров. Рекомендуется воздерживаться от половых контактов в период приема лекарств и барьерная контрацепция в течение 6 мес. после завершения терапии.
Опыт применения Циклоферона в терапии ВПЧ–инфекции. В настоящее время при лечении больных ВПЧ–инфекцией весьма перспективным является направление альтернативного подхода к терапии ПВИ. При данной методике ИФН оказывают протективный эффект, т.е. применяются индукторы интерферона (ИИ), среди которых особого внимания заслуживает отечественный препарат Циклоферон (ООО «НТТФ «ПОЛИСАН», Санкт–Петербург). Циклоферон принадлежит к низкомолекулярным индукторам интерферона, к классу акридонов. При введении Циклоферона образуется эндогенный ИФН, который не обладает антигенностью и пирогенностью; активность индуцированного ИФН контролируется специальными регуляторными механизмами, что обеспечивает отсутствие побочных эффектов свойственных препаратам рекомбинантных ИФН в результате их кумуляции; также Циклоферон не обладает мутагенным, тератогенным, эмбриотоксическим, канцерогенным эффектами; Циклоферон не индуцирует аутоиммунные процессы. У препарата не описано побочных действий, он хорошо сочетается с традиционными терапевтическим средствами лечения (антибиотики, витамины, иммунотропные препараты и т.д.).
Преимущества применения Циклоферона: быстрое проникновение в кровь, низкий уровень связывания с белками сыворотки, высокая биодоступность в органах, тканях, биологических жидкостях организма; преобладающий способ элиминации из организма – через почки (99% введенного препарата) в неизмененном виде, в течение 24 ч [4,5]. После введения Циклоферона высокий уровень синтеза ИФН–a в тканях и органах, содержащих лимфоидные элементы, отмечается на протяжении не менее 72 ч, тогда как в сыворотке крови нормального человека содержание высоких уровней ИФН сохраняется 48 ч.
Механизмы действия Циклоферона. Одним из ключевых параметров при введении в организм интерферониндуцирующих препаратов, определяющих эффективность иммунного ответа, является профиль цитокинов – факторов, активирующих пролиферацию и дифференцировку клеток организма, контролирующих процессы регенерации, ангиогенеза и метаболизма. Установлено существование различных цитокиновых профилей, обеспечиваемых Th–клетками, при этом Th1–тип иммунного ответа ассоциируется с продукцией ИФН–g, ИЛ–2 и ФНО; тип Th2 характеризуется повышением продукции ИЛ–4,5,6,10 и приводит к усилению гуморального и подавлению клеточного иммунитета [4,5]. В настоящее время хорошо описаны прямой и опосредованный иммунотропный эффекты ЦФ.
Влияние Циклоферона на клетки неспецифического иммунитета: Циклоферон повышает образование активных форм кислорода фагоцитами, что способствует завершенному фагоцитозу с элиминацией захваченных возбудителей; вызывает повышение уровня НК клеток в периферической крови.
Влияние Циклоферона на клетки специфического иммунитета: 1) повышение уровня CD4+ и снижение CD8+ Т–лимфоцитов, нормализация иммунорегуляторного индекса уже при однократном применении Циклоферона; 2) применение Циклоферона приводит к снижению уровня В–лимфоцитов в периферической крови и к повышению продукции высокоаффинных антител, что отражает его влияние на переключение синтеза классов иммуноглобулинов в В–клетках; индуцирует синтез ИФН– α в В–клетках, макрофагах и нейтрофилах. Указанные вторичные эффекты Циклоферона могут частично быть объяснены за счет индукции синтеза разными клетками иммунной и других систем организма интерлейкинов (ИЛ–2, ИЛ–1), ИФН– α, ИФН– γ, а также подавления синтеза ИЛ–8, ФНО–a (показано с помощью ИФА, RT–PCR). К другим иммунокорригирующим эффектам Циклоферона можно отнести экспериментально обнаруженный радиозащитный и противовоспалительный эффекты, стимуляцию репаративного остеогенеза (в области перелома трубчатой кости у животных).
Кроме того, показано прямое противовирусное действие Циклоферона, которое проявляется на этапе сборки вируса, приводя к формированию дефект–интерферирующих частиц (ДИ–частиц), которые являются своеобразной аутовакциной в организме. ДИ–частицы препятствуют нормальной репликации вирусов, что ведет к подавлению их цитоцидного действия. При этом ДИ–частицы сохраняют ИФН–индуцирующие свойства, стимулируя неспецифический иммунитет.
Таким образом, Циклоферон, как индуктор ИФН обладает бифункциональным эффектом – он способен подавлять репродукцию широкого спектра вирусов (ортамиксовирусы, парамиксовирусы, аденовирусы, коронавирусы, герпес–вирусы, ВПЧ, ВИЧ и др.) и вместе с тем обладает выраженным иммунокорригирующим эффектом, нормализуя нарушения системы иммунитета (вторичные иммунодефициты), столь характерные для вирусных инфекций. Установлен дозо– и интервалозависимый эффект препарата, что необходимо учитывать при применении Циклоферона [4,5,13].
Формы выпуска Циклоферона. Препарат выпускается в виде раствора для внутримышечного и внутривенного введения 125 мг/мл в ампулах по 2 мл; таблеток по 0,15 г, покрытых кишечнорастворимой оболочкой и линимента 5%–го для наружного применения в тубах по 5 и 30 мл. Линимент Циклоферона 5% 30 мл содержит в одной упаковке пять одноразовых аппликатора для интравагинального введения линимента, что позволяет пациенткам применять препарат в домашних условиях.
Клиническая эффективность препаратов Циклоферона. С учетом противовирусного, интерферон–индуцирующего и иммуномодулирующего действия Циклоферона он активно используется для системного и местного применения в терапии вирусных инфекций, в т.ч. папилломавирусных заболеваний кожи и слизистых оболочек [2,4,7,13]. Циклоферон эффективен в отношении цитомегаловируса, ВИЧ–1, ВПГ, вируса папилломы человека и других вирусов. Циклоферон применяют как монотерапию либо в сочетании с другими противовирусными и иммунотропными препаратами. Так, больным нитевидными бородавками назначали бемитил по 1 таблетке 4 раза/сут. в течение 14 дней с последующей электрокоагуляцией. Внутримышечные инъекции раствора Циклоферона 125 мг/мл по 1 ампуле через день дополнительно назначали больным в случае большого количества бородавок или при развитии рецидивов после местного деструктивного лечения. Курс лечения Циклофероном повторяли через 10 дней. Линимент Циклоферона (лЦФ) назначался при вульгарных бородавках, чередуясь с теброфеновой мазью в течение 4–6 недель (с предварительной обработкой кератолитическими средствами). При отсутствии эффекта проводилось местное деструктивное лечение.
Часто ПВИ сочетается с урогенитальным хламидиозом. При обследовании таких пациенток мы выявляли дисбиоз влагалища и кишечника. Проводилось соответствующее комплексное лечение. Нередко небольшие папилломы уменьшаются в размерах, снижается активность ВПЧ. Если клиническая картина ВПЧ–инфекции оставалась без изменения, то проводили деструктивное лечение основных кондилом и назначали курс Циклоферона внутримышечно: 10 инъекций по 2 мл по основной схеме. Местно использовали аппликации 5%–го лЦФ, в результате применения которого наблюдалась нормализация показателей местного иммунитета и восстановление влагалищной эндоэкологии. Нормализация вагинального микробиоценоза с точки зрения устранения инфекционного агента (антибактериальный, противовирусный, антифунгицидный эффекты) основана в первую очередь на отчетливом иммунокорригирующем эффекте лЦФ. Этот эффект заключается в воздействии на местный иммунитет слизистых нижнего отдела женской половой сферы и состоит в повышении проницаемости вагинального гистогематического барьера (ГГБ) и компенсации исходно сниженного местного синтеза IgG, в начале терапии – за счет повышенной диффузии иммуноглобулинов из кровотока, а в последующем и за счет нормализации и увеличения степени местного синтеза иммуноглобулинов.
Известно, что высокие дозы Циклоферона (500 мг) способствуют активному синтезу ИФН– γ, который обладает иммунорегуляторными и антипролиферативными свойствами, а также обеспечивает индукцию Th1–типа иммунного ответа.
Циклоферон в терапии ПВИ аногенитальной области. Под наблюдением находилось 100 больных обоего пола с ПВИ аногенитальной области в возрасте от 19 до 50 лет. Диагностика проводилась на основании характерных клинических проявлений заболевания, цитологического исследования мазков и методом ПЦР. У 20 больных ВПЧ не обнаружили либо не идентифицировали. У 80 больных при определении типа ВПЧ получили следующие результаты: 40% (32 чел.) – ВПЧ–11, 7% (6 чел.) – ВПЧ–16, 4% (3 чел.) – ВПЧ–6, 4% (3 чел.) – ВПЧ–18. 45% (36 чел.) – идентифицированы ВПЧ–2, 7, 31 и 33. Клинически чаще регистрировали формы ПВИ – остроконечные кондиломы, папилломы и плоские бородавки. Лабораторное обследование: иммунограмма (CD4+ и NK клетки, интерфероновый статус, трансферрин (ТФ), церулоплазмин (ЦП). Для оценки неферментативной антиоксидантной активности определяли коэффициент К, полученный как частное от деления значений ТФ к ЦП (ТФ/ЦП).
Схема терапии ПВИ. Лечение проводили в 2 этапа. Сначала с помощью химической деструктивной терапии удаляли папилломатозные элементы: солкодерм 2 сеанса, с интервалом 4–5 дней. Вторым этапом проводили противорецидивный курс Циклофероном (системно и местно) у 50 больных (36 женщин и 14 мужчин). Раствор Циклоферона 125 мг/мл назначали внутримышечно по следующей схеме: по 2 мл – первый и второй дни, а с третьего дня по 2 мл через 48 ч, курс 8–10 инъекций. Одновременно на места бывших поражений наносили 5%–й лЦФ ежедневно 10 дней. 50 больным контрольной группы (35 женщин и 15 мужчин) были назначены ректальные свечи рекомбинантного a2–интерферона (3 млн МЕ) по стандартной схеме: по 1 св. 2 раза/сут. – 10 дней, затем через день №10.
На фоне терапии Циклофероном быстрее наблюдалась положительная клиническая динамика (разрешение элементов ВПЧ–инфекции и др.), достоверно повышались показатели неспецифической резистентности организма (уровень CD4+, NK–клеток, трансферрин, синтез эндогенных ИФН). Достоверно реже выявлялись ВПЧ методом ПЦР после окончания курса лечения (табл. 1). Применение Циклоферона в комплексной терапии ПВИ позволило снизить частоту рецидивирования ПВИ с 48 до 15% в течение 6 мес. после курса терапии.
Показано, что использование для местной терапии заболеваний урогенитального тракта жидкого 5%–го лЦФ позволяет решить многие проблемы, возникающие при лечении ИППП. Установлено выраженное противовирусное, антибактериальное и антихламидийное действие препарата за счет активации системы иммунитета, противовоспалительное и антипролиферативное действие ЦФ. Показана эффективность лЦФ в комплексной терапии острых и хронических бактериальных и вирусных инфекций (хламидиозы, бактериальные и грибковые инфекции мочеполовой сферы, генитальный герпес, папилломавирусная инфекция).
Считают, что ВПЧ–5, ВПЧ–6 и ВПЧ–11 типов обусловливают развитие остроконечных кондилом (ОК). 28 взрослых больных ОК получили двухэтапное лечение. Сначала проводили удаление ОК методом криодеструкции жидким азотом, затем 17 больным назначили интравагинальные и интрауретральные инстилляции 5% лЦФ 1 раз/сут. №10 через день для предотвращения рецидивов заболевания. 11 пациентам контрольной группы лечение проводили только методом криодеструкции. В течение 10–24 ч на месте криоаппликации развивался отек и гиперемия с последующим образованием пузырей и эрозий. Пузыри и эрозии обрабатывались раствором фукорцина, зона воздействия промывалась раствором хлоргексидина биглюконата в течение 2 недель (с целью профилактики вторичного инфицирования). Полное отторжение новообразований и эпителизация наблюдались на 10–14–й день [13]. В результате лечения у пациентов основной и контрольной групп рецидивы в первые дни после криодеструкции наблюдались у 3 (17,6%) и 2 (18%) больных соответственно. В течение первого месяца после операции рецидивы ОК наблюдались у 4 (23,5%) больных основной и у 3 (27,2%) контрольной групп. В течение второго месяца рецидивы отмечались у 1 (5,8%) и 3 (27,7%) пациентов соответственно. Оценивая полученные результаты, следует отметить эффективность местного применения лЦФ. Так, уже в течение второго месяца после криодеструкции частота рецидивов ОК была достоверно выше в контрольной группе по сравнению с основной группой больных (27,2 и 5,8% соответственно, р<0,05). Заключительное обследование показало, что сочетанная терапия ОК с использованием криодеструкции и инстилляций 5%–ым лЦФ достоверно снижало частоту рецидивирования заболевания в первые 3 мес. после операции: 49,9% в основной и 72,7% в контрольной группе (р<0,05).
лЦФ не обладает побочными эффектами, ограничивающими его использование при интравагинальном/интрауретральном введении и рекомендуется в комплексной терапии урогенитальных инфекций, в том числе и обусловленной ВПЧ. Применение лЦФ эффективно у женщин как в ходе монотерапии урогенитальных инфекций, так и в виде комбинированного лечения. Препарат хорошо сочетается как с различными официнальными интравагинальными препаратами (вагинальных таблеток, свечей), так и с лекарственными смесями, приготовленными ex tempore. Также доказана эффективность лЦФ у женщин при следующих типах патологий: неспецифический бактериальный вагинит, бактериальный вагиноз, кандидозный вагинит, неспецифический уретрит.
Схемы для лечения лЦФ урогенитальных инфекций могут быть вариабельны в зависимости от тяжести заболевания, его нозологической формы и характера местных изменений.
Схемы применения линимента Циклоферона
При генитальном герпесе, рецидивирующих остроконечных кондиломах – интравагинальные (интрауретральные) инстилляции 1 раз/сут. по 5 мл ежедневно, 10–15 дней. Возможно сочетание лЦФ с другими противовирусными средствами (как системными, так и местными) в виде аппликаций мази (геля) к очагу поражения. При терапии кандидозного вагинита, неспецифического вагинита (эндоцервицита) и бактериального вагиноза возможно применение препарата как в виде монотерапии, так и в ходе комплексного лечения. Применяют интравагинальные инстилляции препарата по 5–10 мл ежедневно в течение 10–15 дней. Для предотвращения свободной эвакуации препарата вход во влагалище тампонируется небольшим ватным тампоном на 2–3 ч. Параллельно в случае сочетанного поражения слизистых влагалища и уретры (папилломавирусная инфекция и пр.) целесообразно применение сочетания интравагинальных и внутриуретральных инстилляций (в объеме 5 мл ежедневно, 10–14 дней). Учитывая широкий спектр воздействия 5% лЦФ, можно сказать, что он не только занял свое место в лечении урогенитальных инфекций, но и потеснил традиционные препараты, используемые в лечении ИППП.
Таким образом, показана безопасность и высокая клиническая эффективность применения Циклоферона при лечении больных рецидивирующей ВПЧ–инфекцией. Циклоферон оказывает противовирусный и иммуномодулирующий эффекты, сочетается с основными лекарственными формами, хорошо переносится больными, высокоэффективен при местном и системном применении в качестве монотерапии и в сочетании с противовирусными химиопрепаратами, усиливая и пролонгируя терапевтический эффект.
Литература
1. Ван Крог Д., Лейси С.Д., Гросс Д., Баракко Р., Шнайдер А. Европейское руководство по аногенитальным бородавкам // ИППП. 2002. №3. С.29–37.
2. Дмитриев Г.А., Биткина О.А. Папилломавирусная инфекция. М.: Медицинская книга, 2006. 76с
3. Ермоленко Д.К, Ермоленко К.Д., Исаков В.А. Частота встречаемости вирусов папилломы человека высокого онкогенного риска в ротовой полости у женщин, практикующих коммерческий орально–генитальный секс / 3–я Межрегиональная научно–практ. конф. «Доброкачественные новообразования и инфекции в урологии и гинекологии». СПб., 2008. С. 20–21.
4. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). М.: ГЭОТАР–Медиа, 2005.
5. Ершов Ф.И., Романцов М.Г. Лекарственные средства, применяемые при вирусных заболеваниях. Руководство для врачей.М.: ГЭОТАР–Медиа, 2007.
6. Ершов В.А., Нарвская О.В. Фоновые процессы и неоплазия эпителия шейки матки. СПб.: Человек, 2007. 79 с.
7. Исаков В.А., Ермоленко Д.К., Ермоленко Е.И. Герпесвирусные и папилломавирусные инфекции. / Глава в кн: “Инфекции, передаваемые половым путем”. / Под ред. В.А. Аковбяна, В.И. Прохоренкова, Е.В. Соколовского. Учебное пособие для системы послевузовского профобразования врачей. М.: Медиа Сфера, 2007. С. 448–513.
8. Исаков В.А., Ермоленко Д.К., Кутуева Ф.Р., Ермоленко Е.И., Москвин И.И. Использование циклоферона в терапии папилломавирусной инфекции. Рекомендации для врачей. СПб.–В.Новгород.: Тактик–Студио, 2007. 64 с.
9. Киселев В.И. Вирусы папилломы человека в развитии рака шейки матки. М.: Компания “Димитрейд График Групп”, 2004. 180 с.
10. Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий. Рук–во для врачей. М.: Изд–во “Триада–Х”, 2003. 439 с.
11. Сафронникова Н.Р. Превентивная онкогинекология. СПб.: КОСТА, 2007. 207 с.
12. Семенов Д.М., Занько С.Н., Дмитраченко Т.И. Папилломавирусная инфекция (клинико–патогенетические особенности, лечение, профилактика). Учебно–методическое пособие. СПб.: Диалект, 2008. 83 с.
13. Федотов В.П., Рыбалкин С.Б., Романцов М.Г. Очерки по иммунокоррекции в дерматовенерологии. Пособие для врачей. СПб., 2005.
14. Ludicke F., Stalberg A., Vassilokos P. et al. High and intermediate risk human papillomavirus infectionin sexually active adolescent females. //J. Pediatr. Adolesc. Gynecol.–2001. Vol. 14. N4. P.171–174.
Способ применения и дозы
У взрослых
ЦИКЛОФЕРОН® применяют внутривенно или внутримышечно. При герпесе и цитомегаловирусной инфекции курс лечения состоит из 10 инъекций препарата по 250 мг с интервалом между инъекциями 48 часов (через день). Разовая доза составляет 250 мг (1 ампула). Курсовая доза – 2,5 г. Лечение наиболее эффективно в начале обострения заболевания.
При нейроинфекциях курс лечения состоит из 12 инъекций препарата по 250–500 мг с интервалом между инъекциями 48 часов (через день) в сочетании с этиотропной терапией. Разовая доза составляет 250–500 мг (1–2 ампулы). Курсовая доза – 3,0–6,0 г. Повторные курсы проводят по мере необходимости. При иммунодефицитных состояниях курс лечения состоит из 10 внутримышечных инъекций препарата по 250 мг с интервалом между инъекциями 48 часов (через день). Разовая доза составляет 250 мг (1 ампула). Курсовая доза –2,5 г. Повторный курс проводят через 6–12 месяцев.
При хламидийной инфекции курс лечения состоит из 10 инъекций препарата по 250 мг с интервалом между инъекциями 48 часов (через день). Разовая доза составляет 250 мг (1 ампула). Курсовая доза – 2,5 г. Повторный курс лечения проводят через 10–14 дней. Целесообразно сочетание препарата ЦИКЛОФЕРОН® с антибиотиками.
У детей старше 4 лет
ЦИКЛОФЕРОН® применяют внутримышечно или внутривенно. Разовая доза составляет 6–10 мг на 1 кг массы тела.
При герпетической инфекции курс лечения состоит из 10 инъекций препарата с интервалом между инъекциями 48 часов (через день). При сохранении репликативной активности вируса курс лечения продолжают по поддерживающей схеме –введение препарата один раз в три дня в течение четырёх недель.
Инструкция по применению таблеток Циклоферон
Медикамент показано использовать перорально. Пить таблетки следует за полчаса до приема пищи. Не следует разжевывать таблетированную форму, так как она имеет защитную оболочку, которая не позволяет действующему веществу разрушаться под воздействием желудочного сока. Оболочка таблетки растворяется только в полости кишечника, что повышает эффективность действия лекарства.
Таблетку запивают 50 мл воды. В зависимости от возраста используют разные дозировки:
- взрослые — разовая доза 450-600 мг;
- 7-11-летний возраст — разовая дозировка 300-450 мг;
- 4-6 лет — разовая доза 150 мг.
Повторно курсовую терапию проводят на 14-21 день после окончания первого курса.
Побочное действие
По данным Всемирной организации здравоохранения, нежелательные эффекты классифицированы в соответствии с частотой их развития следующим образом: – очень частые (≥ 1/10); – частые (≥ 1/100 – – нечастые (≥ 1/1000 – – редкие (≥ 1/10000 – – очень редкие ( – частота неизвестна (не может быть определена на основе имеющихся данных). Общие расстройства и нарушения в месте введения: очень редко – озноб, повышение температуры тела, боль и покраснение в месте введения. Нарушения со стороны кожи и подкожных тканей: очень редко – сыпь, крапивница. Если любые из указанных в инструкции нежелательных эффектов усугубляются или Вы заметили любые другие нежелательные эффекты, не указанные в инструкции, сообщите об этом врачу.
Использование линимента
Линимент используется местно. Правила применения при различных состояниях:
- герпес — наносят на поврежденный кожный покров 1-2 раза за день на протяжении 5 суток; при герпетическом поражении половых органов показано наносить на слизистую влагалища однократно на протяжении 5 дней.
- бактериальный или неспецифический вагиноз — интравагинально 5-10 мл 1-2 раза за день; курсовая терапия составляет 10-15 суток; допускается пропитывать линиментом тампон, после чего вводить его во влагалище; медикамент допускается использовать с другими местными средствами (вагинальными таблетками и свечами).
Чтобы ввести линимент внутривагинально, требуется открыть тюбик, проколоть мембрану тубы. Далее следует взять одноразовый шприц с иглой, набрать лекарство в количестве 5-10 мл, снять иглу. Далее рекомендуется лечь на спину, ввести медикамент во влагалище, надавив на поршень шприца. Чтобы лекарство задержалось в полости влагалища, следует поставить ватный тампон на 2-3 часа. Курсовая терапия может длиться до 15 суток. При необходимости лечение повторяют через 2 недели.
Наружный препарат допускается применять при пародонтите. Перед нанесением противовирусного линимента показано промыть пародонтальные карманы. Далее линимент наносят при помощи ватного тампона. Расчет дозы — 1,5 мл на 1 десну. Втирать препарат не рекомендуется. Наносить лекарство желательно 1-2 раза за день. Промежутки между использованием составляют 10-12 часов. Продолжительность лечения составляет до 2 недель. Повторный курс терапии проводят через 2 недели.
Форма выпуска
Раствор для внутривенного и внутримышечного введения 125 мг/мл. По 2 мл в ампулы из коричневого стекла. На ампулу наклеивают этикетку самоклеящуюся. По 5 ампул помещают в контурную ячейковую упаковку из плёнки полимерной. Контурную ячейковую упаковку термосклеивают с плёнкой покровной или оставляют открытой. 1 контурную ячейковую упаковку вместе с инструкцией по медицинскому применению помещают в картонную пачку. Для контроля первого вскрытия боковые клапаны пачки могут быть заклеены этикетками.
Циклоферон: схема приема для взрослых
При респираторных патологиях показано пить лекарство в разовой дозе на 1, 2, 4, 6, 8-й день (потребуется 20 таблетированных форм). Начинать терапию следует при появлении первых признаков болезни. Это повысит эффективность лечения. Если заболевание протекает тяжело, нужно в первые сутки терапии выпить 900 мг, а затем принимать стандартную разовую дозу в остальные дни. Для облегчения состояния вместе с Циклофероном рекомендуется применять лекарства от кашля, температуры.
Герпетическая инфекция лечится по схеме: разовая дозировка в 1, 2, 4, 6, 8, 11, 14, 17, 20, 23 день. Для проведения терапии потребуется 40 таблетированных форм.
Циклоферон взрослым допускается использовать для профилактики респираторных болезней. Схему терапии лучше уточнить у врача.
Циклоферон, 150 мг, таблетки, покрытые кишечнорастворимой оболочкой, 20 шт.
Полисан, Россия
Цена от 389₽
Циклоферон, 150 мг, таблетки, покрытые кишечнорастворимой оболочкой, 10 шт.
Полисан, Россия
Цена от 175₽
Циклоферон, 5%, линимент, 5 мл, 1 шт.
Полисан, Россия
Цена от 174₽
Имеются противопоказания. Необходима консультация специалиста.
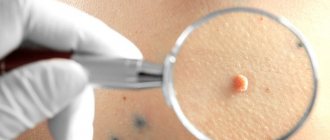
Как пить Циклоферон при ВПЧ
Возбудитель ВПЧ может иметь низкую или высокую онкогенность (способность вызывать онкологические заболевания). Слабо онкогенные микроорганизмы могут провоцировать бородавки на коже. Сильно онкогенные штаммы чаще вызывают образование остроконечных кондилом.
При бородавках допускается применять таблетки Циклоферон на протяжении 2 недель. При ВПЧ с поражением половых органов чаще показана инъекционная форма препарата. При появлении симптоматики ВПЧ следует прийти к дерматологу (а также урологу или гинекологу, если поражены половые органы). Доктор скажет, можно ли пить Циклоферон, назначит правильную терапию. Самостоятельно лечить болезнь не следует.
Особые указания
Перед применением медикамента у пациентов с заболеваниями щитовидной железы следует прийти на прием к эндокринологу. Если была пропущена одна разовая дозировка, ее рекомендовано принять как можно раньше (независимо от промежутка между приемами и удвоения дозы). Далее пьют препарат по схеме. Если медикамент не помогает, рекомендуется прийти на прием к доктору для обследования и коррекции лечения.
Лекарство не оказывает влияния на концентрацию внимания. Во время терапии допускается управлять автомобилем и сложными механизмами.
Для местной формы препарата:
- не следует сильно втирать в десну;
- если медикамент попал на конъюнктиву, следует промыть глаза водой;
- имеет горький привкус.
Когда запрещен медикамент
У медикамента есть абсолютные и относительные противопоказания. К абсолютным относятся:
- период вынашивания плода и грудного вскармливания;
- пациенты младше 4-летнего возраста;
- аллергия на составляющие медикамента.
- больные с циррозом печени в стадии декомпенсации.
Относительными ограничениями являются:
- патологии пищеварительного тракта (язвенные дефекты и воспаления слизистой желудка и 12-перстной кишки);
- отягощенный аллергоанамнез (присутствуют аллергические заболевания, такие как крапивница, поллинозы, аллергический дерматит и другие).
При этих состояниях начинать терапию Циклофероном можно только по рекомендациям доктора.
Что лучше: Кагоцел или Циклоферон?
Циклоферон и Кагоцел относятся к одной группе лекарственных средств. Отличаются медикаменты только временем воздействия. Циклоферон является ранним индуктором интерферонов, Кагоцел — поздним. Соответственно клинический эффект при приеме Циклоферона наступит раньше (на 4 часу после употребления). Оба препарата стимулируют образование собственных эндогенных интерферонов, что снижает вероятность аллергии, в отличие от препаратов интерферона (Анаферон, Виферон), имеющие чужеродные антитела для организма человека.
Циклоферон считается эффективным медикаментом для предупреждения и лечения респираторных заболеваний. Его можно использовать с 4-летнего возраста. Медикамент желательно применять сразу после появления первой симптоматики заболевания, чтобы быстро снизить концентрацию вирусных частиц в крови. Ранее начало терапии предотвратит возникновение тяжелых форм вирусных патологий и развитие осложнений.
Похожие медикаменты
У Циклоферона существуют аналоги, которые имеют похожий лечебный эффект. К ним относят:
- Кагоцел — индуктор интерферонов;
- Виферон — противовирусные медикамент, содержащий интерферон альфа-2b, разрешен новорожденным, беременным; можно при коронавирусе и гриппе в составе общего лечения; эффективность средства достаточно высокая;
- Анаферон — антивирусные препарат, разрешенный с 1 месяца; лекарство менее эффективно;
- Арбидол — содержит умифеновир, разрешен с 3-летнего возраста; можно применять при коронавирусной инфекции в составе основного лечения;
- Амиксин — имеет в составе тилорон, применяется у больных с 7-летнего возраста
Кагоцел, 12 мг, таблетки, 30 шт.
Ниармедик Плюс, Россия
Цена от 639₽
Анаферон детский, таблетки для рассасывания, 20 шт.
МАТЕРИА МЕДИКА ХОЛДИНГ НПФ, Россия
Цена от 236₽
Арбидол, 100 мг, капсулы, противовирусное от гриппа и ОРВИ, 40 шт.
OTC Pharm, Россия
Цена от 936₽
Имеются противопоказания. Необходима консультация специалиста.