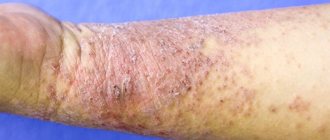
Симптомы пузырчатки
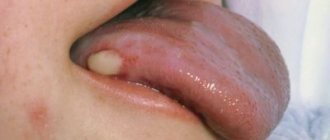
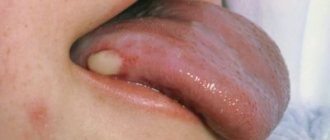
Характерные симптомы пузырчатки – высыпания мелких пузырьков с серозным содержимым. Их локализация зависит от того, какая форма заболевания развивается:
- обыкновенная – появляются высыпания на слизистой оболочке, сопровождающиеся неприятным запахом;
- листовая – на кожных покровах формируются пузырьки, одновременно образуются корочки;
- неакантолитическая – высыпания располагаются на слизистой и губах. Такая форма патологии чаще диагностируется в пожилом возрасте.
При пузырчатке у детей и взрослых также наблюдаются:
- сильная слабость;
- повышенная сонливость;
- ухудшение или полная потеря аппетита;
- похудение даже на фоне употребления калорийной пищи.
Для выявления пузырчатки у новорожденных, более старших детей и взрослых проводятся такие методы обследования:
- осмотр больного и оценка высыпаний;
- проба Никольского – при ее помощи проводят дифференциальную диагностику с другими кожными болезнями;
- гистологическое и цитологическое исследование.
Симптомы пемфигуса (второе название заболевания) нередко похожи на симптомы других патологий, которые будут требовать совершенно иной терапии. Поэтому перед назначением лечения потребуется скрупулезное изучение возникшей симптоматики.
1.Общие сведения
Акантолизом называется один из дегенеративных процессов в коже, проявляющийся в разрушении межклеточных связей в шиповатом слое эпидермиса, вследствие чего клетки утрачивают цитоплазму и на коже возникают множественные пузырьковые образования. Далее, акантолитическую пузырчатку называют «истинной», чтобы подчеркнуть ее отличие от многих других дерматологических заболеваний, которые в медицине или в обыденной речи также называют пузырчаткой.
Истинная пузырчатка, или пемфигус, относится к группе буллезных дерматозов. В этиологии, патогенезе и эпидемиологии пемфигуса по сей день остается много неясного, хотя поток исследований и публикаций данной тематики не иссякает. В частности, до сих пор неизвестно, почему заболевание чаще встречается среди представителей семитских и средиземноморских народностей, почему среди пациентов преобладают лица женского пола, почему наибольшая заболеваемость приходится на возрастной интервал 40-60 лет, и т.д.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Аутоиммунная пузырчатка — аутоиммунный буллезный дерматоз, возникающий из-за наличия аутоантител (ААТ) к антигенам межклеточной связывающей субстанции многослойного плоского эпителия, вследствие чего происходит потеря связей между кератиноцитами (акантолиз) с последующим образованием внутриэпидермальных пузырей [1, 2]. Пузырчатка имеет все признаки, характерные для аутоиммунных заболеваний, которые были сформулированы иммунологами еще в 40-е годы XX века [3]: существование специфических ААТ, появление идентичных кожных поражений у новорожденных от женщин, страдающих пузырчаткой, сочетание с другими аутоиммунными заболеваниями и существование особого активного генетического участка [4].
ААТ и антигены-мишени при аутоиммунной пузырчатке
ААТ аутоиммунной пузырчатки обладают высокой тканевой специфичностью и относятся к IgG. Они не реагируют ни с одним из антигенов тканей других органов, кроме антигенов межклеточной связывающей субстанции (МСС) эпителия и телец Гассаля тимуса человека и животных [4—6]. Патогенетическая роль этих ААТ подтверждена в экспериментах на животных. Клинические признаки заболевания были воспроизведены путем внутриперитонеального введения сывороток, содержащих IgG-антитела, от больных пузырчаткой [7]. В экспериментах in vivo
с новорожденными мышами ВАLВ/с продемонстрировано, что при интраперитонеальном введении IgG-антител пациентов с активной формой заболевания у животных наблюдались клинические признаки заболевания и связывание ААТ в МСС эпителия кожи мыши. Введение IgG от пациентов, находящихся в длительной ремиссии, от здоровых родственников и лиц группы контроля не вызывало клинических симптомов болезни. Это свидетельствует о том, что финальное клиническое проявление заболевания является следствием участия ААТ [8, 9]. Дополнительная ясность появилась после исследований, в которых при культивации человеческой кожи с добавлением IgG из сыворотки крови пациентов с вульгарной пузырчаткой
in vitro
был продемонстрирован акантолиз [9, 10].
Определение субклассов IgG при пузырчатке — интересный и важный момент при изучении заболевания. Во многих исследованиях показано, что у пациентов в активной стадии аутоиммунной пузырчатки выявляются высокие титры IgG1 и IgG4, что свидетельствует об их патогенетической роли при данном заболевании [10—12]. Другие авторы [10, 13] свидетельствуют о том, что гуморальный ответ в активной стадии вульгарной пузырчатки обусловлен чаще субклассом IgG4, а в стадии ее ремиссии — IgG1.
Кроме того, выявлен интересный факт: если IgG1 определялся только на ранних стадиях клинических проявлений аутоиммунной пузырчатки, то IgG4 обнаруживался на протяжении всего периода болезни [14]. Эти результаты позволяют предположить, что переход от доклинической стадии заболевания в клиническую, а также от стадии ремиссии к активному процессу тесно связан с переходом субклассов от IgG1 к IgG4. Кроме того, полученные результаты показывают, что IgG1-антитела сами по себе не в состоянии вызвать болезнь. Так, M. Lin и соавт. [12, 15] установили, что IgG1-антитела здорового человека, имеющего только IgG1-ответ, не способны вызвать симптоматику болезни на экспериментальной модели (мыши) при пассивной их передаче в дозе 15 мг/кг, а IgG4-антитела больных пузырчаткой способны спровоцировать развитие болезни при введении животным малых доз IgG4-антител (1,5 мг/кг), концентрация которых была в 10 раз меньше, чем при введении IgG1-антител.
Некоторые авторы [16—19] при изучении патогенеза пузырчатки не отметили связи между возрастом, полом, тяжестью или степенью активности заболевания и типом субклассов IgG. Так, при изучении срезов кожи пациентов в активной стадии вульгарной пузырчатки прямым методом иммунофлюоресценции отмечено, что IgG1 и IgG4 являются наиболее часто встречаемыми субклассами, но выраженная иммуногистохимическая картина наблюдалась только при IgG4. У большей части пациентов в стадии ремиссии показано отложение IgG1- и IgG4-антител. Крайне редко отрицательными бывают как IgG1, так и IgG4 [18].
При разных формах пузырчатки уровень и интенсивность фиксации Ig и отложения иммунных комплексов в эпителии кожи различны. Наиболее интенсивная фиксация антител в эпидермисе наблюдается при вульгарной пузырчатке, если антигеном-мишенью является десмоглеин 3 [4, 20—22]. При вульгарной и вегетирующей пузырчатке фиксированный Ig локализуется в межклеточных пространствах преимущественно базального и шиповатого слоев, в случаях листовидной и себорейной пузырчатки — в межклеточной субстанции шиповатого и преимущественно зернистого слоев эпидермиса, при паранеопластической пузырчатке — в межклеточной субстанции всех слоев эпидермиса [4]. Фиксированный IgG можно также обнаружить в цитоплазме акантолитических клеток и элементов, составляющих дно или покрышку пузыря. Это явление обусловлено эндоцитозом свободных иммунных комплексов или пропитыванием ими погибших кератиноцитов [5].
Локализация антигенов, к которым направлены антитела, совпадает с локализацией первичных деструктивных изменений в эпидермисе. Связанные с тканями Ig и иммунные комплексы, определяемые методом иммунофлюоресценции, обнаруживаются как в участках клинически пораженной кожи, так и на участках без видимых поражений, а также в периоды обострения или ремиссии заболевания при отсутствии кожных высыпаний, что свидетельствует о систематической тканевой реакции [4].
В настоящее время установлено, что мишенью для ААТ, кроме молекул адгезии и гликопротеинов десмосом, могут быть кадгерины (десмоглеины и десмоколлины), плакоглобин, энвоплакин и периплакин. В последние годы идентифицированы два новых антигена (пемфаксин и α9-ацетилхолиновый рецептор) из группы холинергических рецепторов, которые присутствуют на поверхности кератиноцитов [4].
Сами по себе ААТ или аутоспецифические В-клетки не способны вызвать развитие аутоиммунного процесса. В патогенезе аутоиммунных заболеваний, в том числе аутоиммунной пузырчатки, важную роль играют регуляторные нарушения в иммунной системе. Однако даже при наличии таких регуляторных нарушений аутореактивные клетки могут находиться в состоянии иммунологической толерантности, а начало аутоиммунного процесса инициируется патогенными, экзогенными и/или эндогенными факторами [23].
Генетическая предрасположенность и триггерные факторы при аутоиммунной пузырчатке
В патогенезе аутоиммунной пузырчатки основную роль играет генетическая предрасположенность. Во многих исследованиях обнаружены ААТ пузырчатки у родственников больных первой степени родства. Так, ряд авторов [24—26] с помощью методов иммунофлюоресценции и иммуноблоттинга в 50% случаев отметили в сыворотке здоровых родственников (первой степени родства) низкий уровень ААТ вульгарной пузырчатки. При этом в группе контроля (здоровые доноры) результаты были отрицательными. Наследование этих антител у бессимптомных родственников было связано главным образом с комплексом гистосовместимости (human leucocyte antigens — HLA), чаще всего с DR4- или DR6-гаплотипами пациентов. Вероятно, болезнь появляется у восприимчивых людей с низкими уровнями антител после того, как второй (внешний) фактор побуждает синтез высоких уровней антител, достаточных для формирования пузырей [27]. Условием к способу наследования этих заболеваний является распределение аллелей HLA в популяции или среди пораженных единокровных детей [28, 29]. После анализа распределения DR4, DQ8 на MHC (major histocompatibility complex — главный комплекс гистосовместимости) гаплотипах среди пациентов с вульгарной пузырчаткой было выявлено, что ген восприимчивости HLA является доминирующим [23].
Хотя и существует генетическая предрасположенность к пузырчатке, вопрос, почему у родственников пациентов не проявляется клиническая картина заболевания, остается без ответа. В некоторых исследованиях показано, что титры антител, обнаруженные в сыворотке родственников, не были достаточно высокими для того, чтобы связать антигены в коже и вызвать акантолиз при пузырчатке [26].
Почти во всех этих исследованиях циркулирующие антитела обнаружены при исследовании сыворотки крови непрямым методом иммунофлюоресценции, в то время как при исследовании клинически интактной кожи прямым методом иммунофлюоресценции результаты были, как правило, отрицательными [21]. Это позволило предположить наличие иммунологических или механических барьеров, препятствующих взаимодействию циркулирующих антител IgG с антигенами кожи. Этот барьер может быть разрушен лекарственными препаратами, злокачественными новообразованиями, вирусными инфекциями или травмами, которые могут привести к развитию клинических проявлений заболевания. Изучение вариабельности восприимчивости кератиноцитов или проницаемости эпидермиса, таким образом, может помочь определить, у кого проявится клиническая форма болезни, которая остается бессимптомной, несмотря на циркулирующие антитела пузырчатки [25].
На основании результатов этих исследований [30] можно заключить следующее: хотя иммуногенетические факторы составляют основную часть в патогенезе пузырчатки, но они не являются достаточными для проявления и развития заболевания. Преобладает представление о том, что пузырчатка возникает из-за комбинации эндогенных и экзогенных факторов у генетически предрасположенных к заболеванию людей [31, 32]. Эти факторы многочисленны и включают такие, как лекарственные препараты, ультрафиолетовое излучение, стрессы, инфекции, гормональные нарушения и др. [33—39].
Роль лекарственных препаратов в развитии аутоиммунной пузырчатки
У многих пациентов с пузырчаткой могут быть обнаружены возможные дополнительные этиологические факторы, такие как лекарственные препараты или экологические факторы (физические агенты, инфекции) [40]. Роль лекарственных препаратов в патогенезе пузырчатки стала известна с 1969 г., когда R. Degos и соавт. [41—45] описали случай пузырчатки, вызванной пеницилламином, и была выделена группа тиоловых веществ среди других лекарственных средств. Тиоловая группа включает пеницилламин, который в настоящее время редко используется, и препараты, которые применяются чаще (некоторые ангиотензинпреобразовывающие ферментные ингибиторы, например, каптоприл). Во Франции считалось, что прием этих препаратов в 10% случаев приводит к появлению высыпаний, подобных высыпаниям при пузырчатке (лекарственная пузырчатка) [46]. Лекарственная пузырчатка может быть разделена на две группы: индуцированная пузырчатка и триггерная пузырчатка [42, 44]. При индуцированной пузырчатке происходит регресс заболевания после отмены вызывающего его лекарственного средства. Триггерная пузырчатка сохраняется даже после отмены провоцирующего фактора [47]. При этом синдроме трудно поставить диагноз, так как не только клиническая картина имеет сходство с таковой при аутоиммунной (идиопатической) пузырчатке, но и интервал между первым приемом лекарственного препарата и началом проявлений болезни может занимать несколько дней или даже лет [41, 42]. Наиболее характерным признаком причинной связи лекарственного препарата является выздоровление пациента после его отмены. Однако более чем у 50% пациентов с лекарственной пузырчаткой заболевание продолжает прогрессировать, несмотря на прекращение приема лекарственного средства [48].
Основные группы лекарственных препаратов, способных вызвать пузырчатку: тиоловые препараты — средства с тиолом (каптоприл, пеницилламин, пиритинол, тиопронин) и с тиоловыми метаболитами (карбимазол, пенициллин, пироксикам); средства, не содержащие тиол, — антибиотики (цефалоспорины, этамбутол, изониазид, пентахлорфенол, рифампицин), пиразоловые лекарственные препараты (аминофеназон, аминопирин, азапропазон, норамидопирин, фенилбутазон); другие лекарства — аценокумарол, героин, гидантион, имиквимод, иммуномодуляторы (интерлейкин-2, интерферон-α2, интерферон-β), изотретиноин, лизин ацетилсалицилат, фенобарбитал, прогестерон, пропранолол, препараты с сульфгидрильной группой [41, 42, 44, 45].
Роль продуктов питания при аутоиммунной пузырчатке
Тиоловая группа, кроме лекарственных препаратов, также является частью молекулярной структуры веществ, содержащихся в определенных продуктах питания. Именно поэтому при употреблении этих продуктов могут возникнуть те же эффекты, что и при применении лекарственных средств, содержащих группу тиола [49]. В исследованиях in vitro
показано, что три соединения, входящие в состав чеснока (аллимеркаптан, аллиметилсульфид, аллисульфид), вызывают акантолиз [50]. Чеснок, так же как лук, лук-шалот и лук-порей, относятся к группе продуктов
Alliuma
, содержат группу тиола. В гористых (гималайских) зонах Индии есть много диких разновидностей
Allium L.
, которые постоянно появляются на рынках [51]. Свидетельством причастности тиолсодержащих продуктов в аутоиммунитете являются истории болезни, в которых указывается на начало аутоиммунной пузырчатки после употребления чеснока и лука [52, 53]. Удаление из рациона этих продуктов способствовало началу ремиссии, а возобновление их употребления в пищу вызывало обострение.
Разные тиоловые группы также содержатся в семействе горчицы, которая имеет 3200 разновидностей и 375 родов и распространена повсеместно [54]. Горчица относится к семейству Cruciferae, так же как хрен, репа, брокколи, редька, капуста, брюссельская и цветная капуста. В зависимости от химической структуры состав этих продуктов может являться раздражителем, способным вызывать антителоиндуцированный акантолиз, или проникать в эпидермис, приводя к неиммунологическому биохимическому акантолизу, подобно тиоловым лекарственным препаратам [55]. Так, себорейная пузырчатка была индуцирована аллергическим контактным дерматитом, вызванным настойкой бензойной смолы или контактом с хроматом; были описаны случаи возникновения пузырчатки контактом с фенолами [56, 57]. Танины являются продуктами, содержащими большое количество биологически активных фенолов. Терпкость многих фруктов во время начала роста происходит из-за высокого содержания в них танина, которое уменьшается по мере созревания фрукта. Многофенольные составы вызывают апоптоз [58]. Танины также вызывают закрепление IgA на эритроцитах, вступают в реакцию со структурами на поверхности и в мембране эритроцита [59]. Танин часто используется в качестве поперечно-связывающего средства [60]. Подобная поперечная связь в эпидермисе может быть механизмом, через который подобные составы способны вызывать токсическую пузырчатку. Точно так же при лекарственном акантолизе первым шагом является закрепление лекарственного средства на клеточной мембране. Танины могут активизировать тромбоциты. В исследованиях in vitro
танин оказывал цитотоксическое действие на человеческие лимфоциты периферической крови. Этот эффект зависел от увеличения концентрации и сроков воздействия [61].
Танин содержится в таких продуктах, как маниока, или юкка (распространена в Южной Америке, Африке и Азии), в манго, гуаране, орехе, коле, черном грецком орехе, малине, вишне, клюкве, ежевике, розмарине, ванилине, кофе, семенах какао, корне имбиря, женьшеня и чеснока, чае, матэ, разных специях, таких как кориандр, тмин, черный перец, чеснок [62]. Существуют данные, согласно которым танин содержится в воде южноамериканских рек, в частности, в эндемических областях Бразилии. Большинство пациентов с эндемической листовидной пузырчаткой живут в непосредственной близости от рек. Многие из этих рек содержат большое количество танина, попадающего в воду из окружающих лесов. Число новых случаев возникновения эндемической пузырчатки увеличивается в сезон дождей и уменьшается в сухой сезон. Ливни вызывают увеличение уровня воды в реках и соответственно в воде увеличивается количество органических веществ, в том числе танинов. Хлорирование воды ведет к формированию иона гипохлорита, который соединяется с фенолсодержащими составами даже при высоком разведении. Таким образом, можно пробовать контролировать распространение эндемической пузырчатки [49].
Суммируя сказанное, можно сделать выводы о том, что диета играет значительную роль в развитии аутоиммунной пузырчатки:
1) молекулярная структура веществ многих пищевых продуктов схожа со структурой лекарственных препаратов, способных вызвать пузырчатку;
2) описаны случаи, указывающие на связь возникновения заболевания с характером пищи [52, 53];
3) танины и фенолы активно взаимодействуют с белками;
4) сезонные изменения заболеваемости пузырчаткой в некоторых странах совпадают с сезонными изменениями содержания танина в диете;
5) уровень заболеваемости эндемической пузырчатки уменьшается по мере уменьшения количества населения в сельских областях и перемещения в города с центральным водоснабжением [49].
Участие пестицидов в развитии аутоиммунной пузырчатки
В работах ряда авторов [63] указывается на роль химических веществ, в том числе пестицидов и разных материалов для работы в саду, в патогенезе аутоиммунной пузырчатки. L. Krain [64] сообщал о первой серии исследования 14 пациентов, которые заболели пузырчаткой после контакта с разными химическими веществами и материалами для работы в саду, и сделал вывод о том, что пестициды являются наиболее вероятной причиной заболеваний. После этого исследования в литературе [57, 65] начали появляться данные о возникновении пузырчатки после контакта с фосфамидами, хромовыми солями, пентахлорфенолом и другими средствами.
Результаты сравнительного исследования, проведенного в Израиле, в отношении рода деятельности пациентов указывают на связь между характером деятельности и возникновением аутоиммунной пузырчатки. На работе большинство обследованных пациентов подвергались воздействию химических веществ, чаще всего пестицидов, используемых для работы в саду. Кроме того, 1/3 пациентов в начале их заболевания жили в сельских районах, где контакт с пестицидами больше, чем в городе [39].
Существует несколько механизмов, которые могли бы объяснить, какую роль пестициды играют в патогенезе пузырчатки. Многие из них могут вызвать прямое токсическое воздействие на десмосомы, в то время как другие активизируют иммунную систему, особенно T-хелперы, производящие многие цитокины, что вызывает усиленную выработку ААТ [66]. Была выдвинута гипотеза, согласно которой рецептор ацетилхолина и поверхностные белки клеток, измененные разными пестицидами, являются мишенью для антител пузырчатки [67].
Роль ультрафиолетового излучения в развитии аутоиммунной пузырчатки
Среди физических факторов наиболее часто встречаются сообщения о воздействии ультрафиолетовых лучей. В Израиле проведены исследования, в которых указывалось на то, что приблизительно 40% пациентов непрерывно подвергались воздействию ультрафиолетового излучения в течение 5 лет до развития пузырчатки. Данные о расположении поражений на подвергавшихся воздействию солнца областях и высокой распространенности эритематозной (себорейная) пузырчатки у обследуемых подтверждают результаты этих исследований. Однако остается открытым вопрос о том, заключается ли механизм просто в фототоксическом эффекте или влечет за собой определенный иммуномодуляторный процесс [39].
Кератиноциты синтезируют и секретируют фермент урокиназу типа активатора плазминогена (urokinase-type plasminogen activator — uPA), который связывается со специфическими рецепторами урокиназы типа активатора плазминогена (urokinase-type plasminogen activator receptor — uPAR) матричной рибонуклеиновой кислоты (мРНК) на кератиноцитах [68]. При связывании рецептора с uPA урокиназа протеолитически расщепляет многие внеклеточные компоненты, что ведет к околоклеточному протеолизу. Деятельность uPA находится под контролем специфического белка ингибитора активатора плазминогена (plasminogen activator inhibitor — PAI). Активация системы урокиназы наблюдается при разных физиологических и патологических состояниях, включая вторичную эпителизацию кожных ран, онкологию и аутоиммунные кожные заболевания, в том числе разные формы пузырчатки [68—70].
Одним из патофизиологических механизмов, кроме связывания ААТ, которые способствуют развитию акантолиза и образованию пузырей, является активация протеаз, особенно uPA. Это мнение поддерживается некоторыми данными [71]: с помощью иммуногистологических методов, с помощью которых uPA и uPAR были обнаружены в эпидермисе с акантолизом у пациентов с вульгарной пузырчаткой, но не были обнаружены в коже здоровых людей. Также выявлено, что в культуре кератиноцитов фракция IgG из сывороток больных с вульгарной пузырчаткой индуцируют экспрессию uPA и uPAR [72]. Пузырчатка или плазминогениндуцированный акантолиз в органных культурах кожи ингибируется антителами анти-uPA, антителами анти-uPAR, очищенными PAI-2 или синтетическими ингибиторами протеиназ [73—76]. Плазмин является активным ферментом при акантолизе [77].
В исследованиях методом иммуноферментного анализа показано, что ультрафиолет В (UVB) в концентрации 15 мДж/см2 через 24 ч после облучения увеличивает выработку связанных с клетками uPA и содержание uPА в супернатантах и это явление сохраняется в течение 48 ч после облучения. Излучение UVB также увеличивает концентрацию uPAR в экстрактах культуры облученных клеток более чем в 2 раза. Также UVB-облучение увеличивает количество uPAR примерно в 5 раз. Уровень мРНК медленно увеличивается, достигая максимального значения через 24 ч после облучения без явного снижения в течение оставшегося времени наблюдения (до 36 ч после облучения) [78].
Таким образом, в исследованиях in vitro
показано, что UVB индуцирует выработку uPA и uPAR. Это позволяет предположить, что активация протеолитической системы uPA ультрафиолетовым излучением может способствовать фотопровокации акантолитического поражения при пузырчатке. Уникальной особенностью uPA является то, что при присоединении к uPAR его протеолитическая активность сосредоточена околоклеточно, близко к десмосомам. Наряду с исследованиями
in vitro
, в которых продемонстрировано торможение антителоиндуцированного акантолиза путем ингибирования урокиназы, описанные выше данные демонстрируют uPA как посредника при усугублении акантолиза ультрафиолетовым облучением [73—76, 78].
На основе полученных данных показано, что UVB-облучение способствует экспрессии двух компонентов протеолитической системы — uPA и uPAR в эпидермальных кератиноцитах [78]. Индукция эпидермальных компонентов системы урокиназы UVB-излучением может помочь объяснить механизмы, ответственные за фоточувствительность при пузырчатке.
Участие вирусной инфекции в развитии аутоиммунной пузырчатки
Сделано много сообщений о возможной роли вирусных инфекций в развитии и/или обострении пузырчатки [64, 79, 80—83]. L. Krain [64] впервые отметил начало пузырчатки после перенесенной инфекции вируса простого герпеса (ВПГ). Также существуют работы, в которых описывается начало возникновения и/или обострения заболевания после перенесенной инфекции, вызванной вирусом герпес Зостер, цитомегаловирусом и вирусом Эпштейна—Барр [80—82]. E. Schlupen и соавт. [84] сделали сообщение о 3 случаях обострения аутоиммунной пузырчатки, вызванных ВПГ, который был обнаружен методом полимеразной цепной реакции (ПЦР). Лечение ацикловиром привело к заживлению кожных повреждений. M. Tufano у больных с аутоиммунной пузырчаткой также продемонстрировал наличие дезоксирибонуклеиновой кислоты (ДНК) ВПГ 1-го и 2-го типа в 50% случаев в периферической крови и в 71% — в поврежденной коже; ДНК вируса Эпштейна—Барр в 15% случаев — в периферической крови и в 5% — в поврежденной коже и ДНК человеческого герпес-вируса 6-го типа в 20% случаев только в периферической крови [85]. Однако невозможность обнаружить ДНК герпес-вируса у некоторых больных позволяет предположить, что вирусная инфекция может случайно присутствовать и обнаруживаться при начале и/или обострении аутоиммунной пузырчатки. Однако существует много сообщений, в которых демонстрируется связь между возникновением аутоиммунной пузырчатки и вирусной инфекцией, где началу пузырчатки предшествовала перенесенная вирусная инфекция [34, 86—88].
Обнаружено наличие ДНК вируса герпеса человека 8-го типа (ВЧГ-8) в пораженной коже пациентов с вульгарной и листовидной пузырчаткой [89, 90]. Эти находки позволяют предположить, что ВЧГ-8 играет роль в большем числе кожных поражений, чем только при кожных опухолях, и он может быть включен в список факторов, играющих роль в патогенезе пузырчатки. Для того чтобы оценить, насколько вирус связан с пузырчаткой и другими буллезными дерматозами, проведено исследование, в котором определяли наличие ВЧГ-8 у больных с вульгарной и листовидной формами пузырчатки, а также с буллезным пемфигоидом, приобретенным буллезным эпидермолизом, герпетиформным дерматитом Дюринга и доброкачественной семейной пузырчаткой Гужеро—Хейли—Хейли [91]. При исследовании методом ПЦР кожи из очага поражения и сыворотки крови у 7 из 9 больных вульгарной пузырчаткой и у 1 из 2 больных листовидной пузырчаткой были обнаружены 160-bp ДНК ВЧГ-8. В образцах кожи контрольной группы (3 больных с приобретенным буллезным эпидермолизом, 4 — с герпетиформным дерматитом Дюринга, 7 — с доброкачественной семейной пузырчаткой Гужеро—Хейли—Хейли, 3 больных с обнаруженным в коже ВПГ, 3 больных с псориазом и 5 здоровых людей) ВЧГ-8 не обнаружен. Наличие ДНК ВЧГ-8 в периферической крови и коже с очага поражения больных аутоиммунной пузырчаткой, но отсутствие ВЧГ-8 в клинически интактной коже у больных аутоиммунной пузырчаткой и в коже пациентов из группы контроля позволяет предположить, что ВЧГ-8 специфичен только для поврежденной кожи и вовлекается только в некоторые моменты течения аутоиммунной пузырчатки [89, 90].
Могут быть несколько объяснений связи между пузырчаткой и ВЧГ-8. Во-первых, ВЧГ-8 может являться только оппортунистической инфекцией. Пациенты с пузырчаткой обычно получают иммуносупрессивную терапию в течение длительного периода, и в некоторых случаях вирусассоциированной пузырчатки вирусная инфекция появляется из-за глюкокортикоидной терапии и может появляться до клинических проявлений пузырчатки [34, 86]. Это означает, что риск развития герпетической инфекции может увеличиваться при иммуносупрессивной терапии. Однако обследованные пациенты до проведения исследования не получали иммуносупрессивную терапию, а результаты другого исследования не зависели от ее проведения [90]. Во-вторых, существует возможность существования положительных результатов без патогенетической обоснованности. Это может свидетельствовать о наличии персистирующего вируса герпеса или интактной вирусной ДНК, подобно патогенным вирусам в пораженной коже [84]. В-третьих, вирус может играть роль триггера только у определенной части пациентов. Герпесвирусная инфекция может вызывать разрушение тканей путем нарушения регуляции и увеличения продукции гуморального и клеточного ответов, что может привести к развитию пузырчатки или повысить презентацию антигенов у генетически предрасположенных людей [85, 90].
Интерферон-γ, продуцируемый Т-клетками, пораженными вирусом герпеса, индуцирует выработку HLA II на клеточных мембранах кератиноцитов, формируя иммунологически активный структурный сайт антигена пузырчатки. При хронической вирусной инфекции или ее реактивации происходит цитокиновое «переключение» Т-хелперов 1-го типа на Т-хелперы 2-го типа (Th1→Th2) и производятся интерлейкины (ИЛ-4 и ИЛ-10), что в дальнейшем стимулирует ответ антител. Таким образом, активируется аутоиммунный каскад. Посредством цитотоксических эффектов и ААТ индуцируется появление пузырчатки [85, 92].
Роль традиционной косметики в развитии аутоиммунной пузырчатки
В Тунисе, как и в других частях арабского мира, преобладает листовидная пузырчатка. Чаще она встречается у молодых женщин [93, 94]. При сравнительном исследовании эпидемиологии пузырчатки в Тунисе и Франции показано, что заболеваемость как листовидной, так и вульгарной формами пузырчатки выше в Тунисе и чаще встречается у молодых жительниц из сельских районов [95]. Однако отсутствие заболеваемости среди детей и преобладание заболевших молодых женщин контрастируют с данными, полученными в Бразилии. Проведено исследование по выявлению факторов риска в Тунисе: учитывались такие факторы, как беременность, использование противозачаточных средств, факторы окружающей среды (в том числе в Бразилии), традиционные атрибуты тунисской жизни (традиционная косметика, посещение турецкой бани) [96].
Отмечено, что практически все заболевшие женщины использовали традиционную косметику (краску для век, хну). Также заболевшие чаще, чем здоровые, посещали турецкие бани. Тунисские женщины обычно начинают использовать традиционную косметику после вступления в брак для ежедневного ухода и для общественных мероприятий [97]. Традиционная краска для век, по-видимому, состоит из сурьмы, а в некоторых образцах обнаружены такие элементы, как свинец, алюминий, углерод, железо, титан, серебро, кремний [97, 98]. Для получения краски хны используют сухие листья безостой Lawsonia
, которую смешивают с маслами и разными веществами, такими как порошок угля, ламповая копоть и средство «секретные формулы», возможно, содержащие р-фенилендиамин. На хну часто возникают такие реакции, как крапивница, отек Квинке, контактный дерматит [99, 100]. Предполагают, что хна может быть сильным аллергеном.
Таким образом, частое использование молодыми женщинами традиционной тунисской косметики может указывать на то, что традиционная косметика является триггерным фактором для развития пузырчатки. Очень высокая распространенность использования косметики по сравнению с относительно низкой частотой заболеваемости пузырчаткой обосновывает гипотезу о взаимодействии между индивидуальной восприимчивостью и факторами риска. Таким образом, в Тунисе патогенные реакции ААТ у предрасположенных лиц могут быть вызваны и поддерживаться хронической антигенной стимуляцией, связанной с использованием косметики [96].
Заключение
Таким образом, при изучении патогенеза аутоиммунной пузырчатки большая роль отводится изучению ААТ пузырчатки — IgG и их субклассовой характеристике при этом буллезном дерматозе. Патогенность IgG-аутоантител подтверждена экспериментально на моделях животных. При внутриэпидермальном введении IgG-антител пациентов с разными формами пузырчатки у животных развивались буллезные высыпания, аналогичные высыпаниям при пузырчатке.
Значительный интерес для исследователей представляет изучение влияния антител субклассов IgG на развитие аутоиммунной пузырчатки. Так, большинство исследователей констатировали присутствие в сыворотке больных пузырчаткой антител, содержащих все четыре субкласса IgG. Однако наиболее часто встречались субклассы IgG1 и IgG4. При этом уровень IgG4-антител был значительно выше у пациентов с пузырчаткой, чем у их родственников. Это позволило сделать вывод о том, что IgG4 является основным субклассом при аутоиммунной пузырчатке независимо от клинических форм ее проявления.
Одно из доказательств аутоиммунной природы пузырчатки — генетическая к ней предрасположенность. В многочисленных исследованиях показана связь заболевания с HLA II класса, выявлено разнообразие гаплотипов у разных рас. Имеются сведения о том, что независимо от расы при вульгарной пузырчатке встречаются гены DRB1*04 и DRB1*14. Они выявляются и и у большинства больных листовидной пузырчаткой. Однако, несмотря на генетическую предрасположенность, заболевание развивается не у всех. Показано, что аутоиммунная пузырчатка развивается у генетически предрасположенных представителей под воздействием провоцирующих факторов. Определение таких факторов волнует ученых в большинстве стран мира. Во многих исследованиях показана провоцирующая роль лекарственных препаратов, продуктов питания, солнечного воздействия, гормональных нарушений, вирусных инфекций, длительного контакта с некоторыми химическими препаратами. Существуют разные мнения относительно механизма действия провоцирующих факторов. Одни авторы считают, что такие факторы могут оказывать прямое токсическое воздействие на десмосомы, другие — что воздействие провоцирующих факторов может активизировать иммунную систему (синтезом множества цитокинов) и соответственно вызывать усиленную продукцию ААТ.
Таким образом, изучение аутоиммунной пузырчатки на молекулярно-биологическом уровне способствует не только выяснению патогенеза этого заболевания на современном этапе, но и расширяет практические клинические знания. Последнее позволяет врачам прогнозировать течение и проводить профилактические мероприятия по предотвращению развития и рецидивирования столь угрожающего для жизни заболевания.
Профилактика заболевания
Для предотвращения развития вирусной пузырчатки рекомендовано соблюдать простые методы профилактики:
- У детей в любом возрасте должны быть свои приборы для личной гигиены. Особенно это касается зубных щеток, мочалок и полотенец. Полотенце необходимо менять каждые два дня. Перед этим проутюжив вещь под высокой температурой;
- Следует соблюдать правильное питание, исключить поступление вредных продуктов. В рационе должны присутствовать все необходимые витамины и минералы для повышения иммунитета;
- Детская комната должна содержаться в чистоте;
- Одежда должна быть чистой и меняться ежедневно;
- Исключить контакт с инфицированными людьми;
- Следить за соблюдением правильной гигиены, особенно после посещения общественных мест;
- Своевременно лечить все возникшие заболевания, не заниматься самолечением.
Соблюдение таких простых мер профилактики позволяет снизить вероятность заболевания вирусной пузырчаткой. Однако родители должны знать, что от риска заражения вирусной пузырчаткой не защищен никто.
2.Причины
Как указано выше, этиопатогенез акантолитической пузырчатки к настоящему времени в точности не установлен.
Выдвигаются и рассматриваются различные гипотезы на этот счет (вирусная, метаболическая, неврогенная, токсическая, гормональная и др.), однако убедительные подтверждения получены лишь в отношении того, что ведущую роль в развитии пемфигуса играют аутоиммунные механизмы. Однако первопричины такой атаки со стороны собственного иммунитета, триггерные факторы и факторы риска (за исключением принадлежности к женскому полу или к определенной генетической линии) пока неизвестны.
Посетите нашу страницу Дерматология
Осложнения
При неправильном лечении вирусной пузырчатки могут возникать следующие виды осложнений:
- Образование хронической формы заболевания;
- Инфицирование ран с выделением гноя;
- Сбои в работе внутренних органов;
- Менингит;
- Развитие пневмонии;
- Большая потеря веса;
- Возможность наличия пятен и шрамов после лечения заболевания.
Пузырчатка может покрыть все тело у ребенка и вызвать другие виды кожных заболеваний, которые усугубляют протекание вирусного заражения.