Что такое Лечение спаек после операции?
На практике же это выглядит так: в местах повреждений серозной оболочки усиленно вырабатываются коллагеновые и эластичные волокна и клетки соединительной ткани. Если в это время какой-нибудь внутренний орган (например, петля кишки) прикасается к участку поврежденной серозы, он поневоле вовлекается в этот процесс. Образуется тяж из соединительной ткани, который ведет от стенки внутренних органов к внутренней поверхности брюшной стенки. Это и называется спайкой.
Спайки могут соединять и внутренние органы друг с другом. Каждый из них также покрывает серозная оболочка. Во время операции не исключены ее микро-надрывы. И эти места микротравм также могут впоследствии стать источником формирования спаек между этим органом и органами прилегающими к нему.
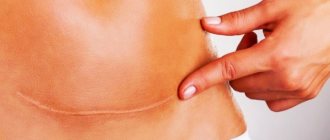
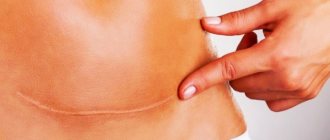
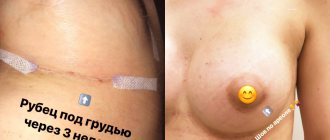
Также на участке соприкосновения и заживления тканей после их рассечения или разрыва может образоваться рубец, при котором обычная ткань заменяется более жесткой и неэластичной соединительной. Рубцы могут быть на коже, а могут быть и на внутренних органах.
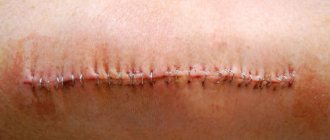
Классификация послеоперационных швов
То, как быстро срастутся швы после операции, во многом зависит от характера их наложения и использованных материалов. В этой связи постхирургические процедуры принято классифицировать следующим образом.
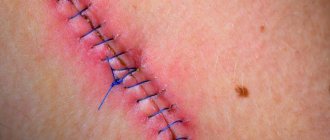
- Бескровные (края раны склеиваются специальным пластырем) и кровавые (классический шов, который накладывается медицинским инструментом вручную). В свою очередь последние подразделяются на:
- простые узловые (накладываются на расстоянии 1–2 см друг от друга, после чего узел затягивают до соприкосновения краев разреза);
- внутрикожные непрерывные (считаются самыми эффективными, поскольку после их заживления не остается никаких следов);
- матрацные (накладываются после полостной операции);
- кисетные (применяются в пластической хирургии, а также при операциях по уменьшению объема желудка);
- обвивные (кругообразные швы, которые используются для сшивания сосудов и полых органов).
- Ручные (накладываются иглой, нитью и другим специнструментом) и механические (выполняются медицинским степлером).
- Погружные (накладываются при операциях на внутренних органах рассасывающимися или вживляющимися в живые ткани нитями) и съемные (с их помощью сшиваются кожные покровы, а после срастания краев раны нити удаляются).
Рассасывающиеся швы делаются в тех случаях, когда требуется длительная фиксация краев разреза, например, при разрезе матки во время кесарева сечения. Как правило, они выполняются нитями из очищенной соединительной ткани, которая впоследствии отторгается в полость органа. Для наложения съемных швов применяются нити и другие фиксаторы из хлопка, шелка, металла и других нерассасывающихся материалов (всего более 30 разновидностей).
Инструменты для ручного шва
Как лечат спайки
По срокам формирования спаек различают:
- 7-14 день после операции – фаза молодых сращений, когда спайки еще очень рыхлые и легко рвутся;
- 14-30 день после операции — фаза зрелых сращений, когда спайки уплотняются и становятся прочными.
Начиная с 30-го дня после операции и далее, в течение нескольких лет, происходит процесс перестройки и формирования рубцов и спаек. Процесс индивидуален, многое зависит от свойств самого организма, его анатомического строения, функционирования внутренних органов.
Врач может заподозрить наличие спаечного процесса в брюшной полости по клиническим данным, сбору анамнеза и по результатам таких исследований, как УЗИ, КТ, колоноскопия. Спаечный процесс в брюшной полости и полости малого таза можно лечить медикаментозно или оперативно. При операции спайки разделяют, но к этому методу стоит прибегать только в крайних случаях, если тяжи настолько толстые и грубые, что сильно нарушают функцию органа, а более лояльное и щадящее лечение не помогает.
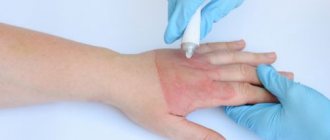
Как ухаживать за швом после операции?
Как только края разреза стянутся, необходимость в их дополнительной поддержке отпадет. Снятие швов в области головы, лица и шеи происходит уже на 5-й день с момента проведения операции. Если же они были наложены в районе туловища или конечностей, то для заживления раны потребуется не меньше 10 суток. Первые несколько дней необходимы ежедневные перевязки. Обычно это время пациент проводит в больнице. После выписки плотные повязки, как правило, уже не нужны. Но при необходимости всегда можно сделать перевязку в ближайшем лечебном учреждении или медицинском центре.
Уход за швом после операции заключается в ежедневной обработке области разреза антисептиком и приеме препаратов, ускоряющих регенерацию тканей. Все лекарственные средства при домашней терапии применяются строго по рекомендации врача!
Обработка швов обычно проводится готовыми аптечными препаратами либо самодельными антисептиками, такими как растворы йода, марганцовки, бриллиантового зеленого или перекиси водорода. Во избежание получения химического ожога при осуществлении таких процедур, готовить жидкость для обеззараживания следует исключительно по рецепту, выданному врачом.
Для форсирования процессов регенерации применяются наружные средства с ранозаживляющим и антибактериальным эффектом. В их числе линимент бальзамический (более известный как мазь Вишневского), левомеколь, ихтиоловая мазь и многие другие.
Болевые ощущения различной интенсивности после операции – явление абсолютно нормальное. При серьезном дискомфорте могут применяться анальгетики, одобренные лечащим врачом.
Симптомы
Первые клинические проявления воспалительного процесса наблюдаются через несколько суток после перенесенной операции. Они проявляются в виде отека и гиперемии раны, имеются жалобы на усиливающиеся болевые ощущения. В ходе пальпации шва хирург обнаруживает уплотнение без четко очерченных границ. Гнойное воспаление сопровождается выделением характерной жидкости – экссудата.
Спустя 1-2 суток появляются дополнительные симптомы:
- мышечные боли;
- интоксикация;
- повышенная температура тела;
- слабость и тошнота.
Анаэробная инфекция развивается гораздо стремительней и уже через двое суток после операции может привести к сепсису без своевременно оказанного лечения.
Дополнительные рекомендации по уходу за швом после операции
Помимо лечебных процедур в послеоперационный период необходима и определенная корректировка образа жизни. В частности, необходимо придерживаться следующих правил:
- Ограничить физическую активность. Любые нагрузки высокой и средней интенсивности (бег, аэробика и т.д.) в этот период строго противопоказаны.
- Избегать подъема тяжестей. Как правило, человеку, перенесшему операцию, нельзя поднимать больше 2–2,5 кг. Особенно актуально это правило при уходе за швом на животе после операции.
- Ограничить подвижность в области талии (избегать резких и высокоамплитудных наклонов и поворотов туловища) после операции на брюшной полости.
- Водные процедуры осуществлять с большой осторожностью. До снятия швов, а лучше до образования рубца, рану настоятельно не рекомендуется мочить.
- Избегать любого давления на рану. В вопросе, как ухаживать за швом после операции, это одно из главных правил.
- В тех случаях, когда операция проведена на руке или ноге, во время сна поврежденную конечность следует поместить выше уровня сердца (например, положить на подушку). Если же рана выше уровня шеи, то спать лучше с поднятым на 45° изголовьем (для этого достаточно двух подушек).
- При полостных операциях соблюдать постельный режим до тех пор, пока врач не разрешит его нарушить. Во избежание пролежней и для улучшения кровообращения можно совершать простые движения вроде подъема конечностей и выполнять легкий самомассаж.
- Неукоснительно соблюдать режим питания, назначенный врачом (особенно после полостных операций).
- Защищать рану от воздействия прямых солнечных лучей. После заживления тканей и до образования на этом месте полноценного кожного покрова можно использовать солнцезащитный крем.
Из-за чего происходит аппендицит?
Аппендицитом называется воспаление червеобразного отростка слепой кишки, аппендикса. Функция аппендикса в организме до конца не установлена. Это скорее рудиментарный орган. Предполагается, что в ходе эволюции человека он утратил свою основную пищеварительную функцию и на сегодняшний день играет второстепенную роль:
- содержит большое количество лимфоидных образований, а значит, отчасти обеспечивает иммунитет;
- продуцирует амилазу и липазу, а значит, выполняет секреторную функцию;
- продуцирует обеспечивающие перистальтику гормоны, а значит, сродни гормональным железам.
Причины возникновения аппендицита описывают несколько теорий:
- механическая утверждает, что поводом к развитию аппендицита оказывается обтурация просвета отростка каловыми камнями или лимфоидными фолликулами на фоне активации кишечной флоры; как следствие в просвете скапливается слизь, размножаются микроорганизмы, воспаляется слизистая оболочка аппендикса, затем происходит тромбоз сосудов и некроз непосредственно стенок отростка;
- инфекционная теория отталкивается от того, что к воспалению аппендикса ведет агрессивное воздействие на отросток инфекционных агентов, локализирующихся здесь; обычно это брюшной тиф, иерсиниоз, туберкулёз, паразитарные инфекции, амёбиаз, однако до сих пор не выявлено специфической флоры;
- сосудистая теория объясняет развитие аппендицита расстройством кровоснабжения этого участка пищеварительного тракта, что возможно, например, на фоне системных васкулитов;
- эндокринная в основу возникновения аппендицита кладет воздействие серотонина, гормона, вырабатывающегося множественными расположенными в аппендиксе клетками диффузной эндокринной системы и выступающего медиатором воспаления.
Аппендицит нередко развивается на фоне других нарушений в работе желудочно-кишечного тракта. Высоко риск аппендицита оценивается для тех лиц, которым диагностированы:
- хронические формы: колита,
- холецистита,
- энтерита,
- аднексита
Аппендицит чаще развивается в возрасте 20-40 лет; чаще болеют им женщины, нежели мужчины. Аппендицит занимает первое место среди хирургических заболеваний органов брюшной полости.
Профилактика аппендицита заключается в исключении негативных факторов, лечении хронических заболеваний органов брюшной полости, исключении запоров и в соблюдении здорового образа жизни. Рацион питания должен включать достаточное количество растительной клетчатки, поскольку именно она возбуждает перистальтику кишечника, оказывает слабительное действие и сокращает время пассажа кишечного содержимого.
В каких случаях следует обратиться к врачу?
Обращение за помощью к врачу в процессе заживления шва является совершенно нормальной практикой даже при отсутствии серьезных проблем. А в случае возникновения побочных реакций из-за нарушения лечебного режима или каких-либо непредвиденных обстоятельств медлить с этим и подавно нельзя. В первую очередь, опасно игнорировать следующие симптомы:
- кровотечение, которое не удается остановить обычными средствами;
- высокая температура (больше 38 градусов);
- слабость, озноб;
- усиливающаяся боль или иной прогрессирующий дискомфорт, который не получается устранить лекарствами;
- гнойные выделения ярко-желтого или зеленого цвета густой консистенции и очень часто с неприятным запахом;
- сильное покраснение, припухлость или отек в области раны;
- кожа в месте повреждения твердая и горячая на ощупь;
- появление сыпи или волдырей;
- подозрение на расхождение шва.
Актуальные вопросы
Большинство пациентов после прохождения процедуры удаления родинки лазером в течение первых двух недель наблюдают некоторые характерные реакции организма, часть из которых является нормальными ответными проявлениями, имеющими компенсаторный характер. Рассмотрим несколько актуальных вопросов относительно последствий удаления невусов на лице и теле.
После удаления родинок может возникнуть рак? Рак кожи, или меланома, обычно развивается как следствие злокачественной трансформации меланомоопасной родинки. При этом, если в процессе лазерной коррекции специалист неправильно определил требуемую глубину воздействия луча и не до конца удалил родинку, риск развития меланомы повышается.
После удаления появился бугорок. Несмотря на малотравматичность методики, в процессе удаления невуса остается здоровая окружающая ткань, которой придется пройти процесс заживления раневой поверхности, сформировавшейся вместо родинки. При этом данная зона может образовать небольшой бугорок, который покроется через несколько дней плотной корочкой. Это считается нормальной реакцией на манипуляцию.
Воспаление после удаления родимого пятна. Воспалительный процесс после лазерной коррекции длится обычно на протяжении первых дней, после чего проходит. Если же воспалительные признаки сохраняются длительное время, необходимо немедленно обратиться к специалисту, проводившему процедуру.
Может ли после удаления невуса образоваться рубец или шрам? Формирование рубцов может наблюдаться только в случае насильственного преждевременного снятия защитной корочки с раневой поверхности.
Чешется и болит шрам после удаления родинки. Зуд, жжение, шелушение и покраснение вокруг родинки после удаления – характерные симптомы ожога, который может быть спровоцирован непрофессиональной работой врача. Такое неприятное осложнение развивается, если специалист неправильно определил глубину воздействия и подверг лазерному выжиганию здоровые клетки кожи.
Сколько времени заживает рана после операции?
Скорость заживления послеоперационной раны зависит от многих условий. В их числе:
- возраст;
- масса тела;
- состояние иммунитета;
- состояние сердечно-сосудистой системы.
В среднем с момента хирургического вмешательства до образования шрама проходит около 3 месяцев. В зависимости от сложности операции и при наличии осложнений этот период может растянуться на 12 месяцев. Регенерация тканей проходит в 4 этапа.
- Воспаление (5–7 дней). Стандартная защитная реакция организма на повреждение. В этот период происходит усиленное производство веществ, стимулирующих свертываемость крови.
- Полиферация (от 10 дней до 1 месяца). На этом этапе происходит образование молодой соединительной (грануляционной) ткани, пронизанной густой сетью микрососудов. Поначалу она ярко-красного цвета и зернистой консистенции, но по мере заживления раны бледнеет и разглаживается, а ее кровоточивость уменьшается.
- Эпителизация (от 1 до 3 месяцев). Соединительная ткань окончательно сформирована. В месте раны начинает создаваться кожный покров. Число сосудов уменьшается, образуется рубец.
- Формирование шрама (от 3 до 12 месяцев). Временные сосуды полностью исчезают. Волокна коллагена и эластина – элементов соединительной ткани – формируют шрам.
Проблема возникновения послеоперационной каузалгии до настоящего времени остается весьма актуальной и далека от окончательного разрешения. Каузалгия (от греч. causis — жжение и algos — боль, буквально — жгучая боль) — болезненное состояние, сопровождающееся мучительными, нестерпимыми болями, которые обычно носят жгучий характер и приступообразно усиливаются, возникают у пациента, как правило, после хирургического лечения, в зоне ушивания брюшной стенки и/или в области интеграции и фиксации имплантата после герниопластик.
У больного возникает ощущение обваривания пораженной области кипятком, прижигания ее раскаленным железом. Легкое прикосновение, сухое тепло вызывают усиление болей, даже при приложении их вне зоны поражения. Приступ болей может быть спровоцирован любым резким раздражением (звук, свет), эмоциями. В зоне поражения отмечаются сосудистые и трофические изменения: стойкое покраснение кожи, повышение ее температуры, истончение, пигментация, нарушение роста ногтей, волос, потоотделения, атрофия костной ткани.
В современной хирургии грыж наибольшей эффективностью обладают способы паховой герниопластики с использованием синтетических имплантатов (аллогерниопластика, ненатяжная герниопластика), применение которых предотвращает основную причину формирования рецидивов — натяжение тканей в зоне операции — и позволяет снизить частоту рецидивирования паховых грыж в среднем до 1—5% [1, 2].
Рандомизированные контролируемые клинические испытания показали однозначно резкое снижение частоты рецидивов по сравнению с методиками использования собственных тканей пациентов при герниопластике. Однако послеоперационные болевые синдромы были признаны одной из основных проблем, связанных с применением имплантатов. По данным как отечественных, так и зарубежных авторов, частота возникновения каузалгии составляет от 4 до 15% [3—5].
Для изучения феномена каузалгии после герниопластик J. Mazin [6] в 2011 г. в рамках своего исследования выполнил ретроспективный поиск литературы с 1998 по 2011 г. В обзор был включен анализ различных открытых и лапароскопических методов герниопластики. Были определены факторы риска развития послеоперационной боли после герниопластики: предоперационная боль, выбор анестезии, страх боли, раневые инфекции, кровотечения, длительность операции и опыт хирурга. Кроме того, были определены 3 отдельных типа хронической послеоперационной боли. Общим фактором в каждом типе боли является наличие сетки.
Первый тип — самый распространенный — соматические или ноцицептивные боли. Как правило, причиной служит предшествующая операции патология. К ней могут относиться травмы связок и мышц, а также агрессивная реакция на возникновение послеоперационного рубца или на внедренную синтетическую сетку-имплантат.
Второй тип — невропатическая боль — включает прямое повреждение нерва. Определенные проблемы могут возникать в ходе операции, например при попадании нерва в шов или захват его скобкой при фиксации сетки. Как правило, это ветви подвздошно-пахового и подвздошно-подчревного нерва, а также латеральный кожный нерв бедра.
Третьим типом хронической послеоперационной боли является висцеральная боль. В принципе этиология этой боли может быть кишечного происхождения, но наравне с этим дизурия или затруднение мочеиспускания также может способствовать возникновению висцеральной боли. Другие мочеполовые проблемы, такие как нарушение эякуляции (обычно предшествовавшее операции) и эректильная дисфункция, могут играть значительную роль в возникновении данного вида боли. Однако следует учитывать, что эректильная дисфункция не может быть вызвана непосредственно хирургическом лечением паховой грыжи. Нервы, ответственные за возникновение эректильной дисфункции, берут свое начало из II по IV сакральных нервных корешков, а не через сенсорные нервы, идущие в паховую область. Таким образом, анатомически невозможно вызвать импотенцию путем хирургического лечения паховых грыж. Несмотря на это, было множество судебных дел, в которых истец, перенесший герниопластику, обвинял хирурга в том, что в результате операции у него возникла импотенция [6].
В результате хроническая послеоперационная паховая боль была определена как боль, длящаяся более 30 дней и оказывающая негативное влияние на повседневную деятельность пациента. Термин «mesh inguinodynia», введенный C. Heise и J. Starling в 1998 г. [7], относился к каузалгиям после герниопластик. Этот термин также хорошо описан и обсужден в 2002 г. C. Courtney и соавт. [8]. Было изучено 5506 больных, оперированных более чем за год.
В исследование были включены все виды герниопластик. Согласно полученным результатам, 3% их пациентов испытали сильную боль через 3 мес, 8% пациентов потребовалась еще одна операция по различным причинам, а 15% были направлены в клиники для лечения боли. Хроническая боль у данных пациентов негативно влияла на ходьбу, работу, сон, межличностные отношения и настроение.
В общем боли различной интенсивности имеются в паховой области после грыжесечения в течение различных промежутков времени. Если боль длится дольше 3 мес, то она классифицируется как хроническая. Через 3 мес после операции можно предположить, что большинство ноцицептивных болевых сигналов, идущих от нормальной заживающей раны, идут на убыль. Следовательно, боль, длящаяся дольше 3 мес, может указывать на патологическое продление ноцицептивной болевой реакции или на воспаление какого-либо нерва. Хотя у большинства пациентов, которые подверглись грыжесечению, через 3 мес болевой синдром купируется, многие из них испытывают дискомфорт или имеют более выраженную боль через несколько лет после герниопластики. Довольно широкий диапазон частоты сообщений о дискомфорте и боли, который варьирует от 0 до более 50%, отражает различные интервалы времени после операции, на которых проводятся измерения, и различные методы оценки. Неизвестно, в какой степени эти изменения в частоте сообщений о боли могут быть отнесены к сочетанию длительной реконвалесценции после операции и рецидива боли, который возник после относительно безболезненного послеоперационного периода.
Исследование, проведенное S. Smeds и соавт. в 2009 г. [9], описывает варьирование послеоперационных результатов в течение первых 2,5 года после операции, при этом основное внимание уделено пациентам без боли, с умеренной и выраженной болью в течение 3 мес после операции. Операции выполнялись авторами в условиях дневного стационара, под общей внутривенной анестезией и искусственной вентиляцией легких. Примерно 80% всех операций было выполнено одним хирургом. Все пациенты получали одну и ту же письменную и устную информацию обо всех этапах операции и премедикации перед операцией. В послеоперационном периоде вводились местные анестетики в рамках стандартного послеоперационного обезболивания (парацетамол/ацетаминофен и дексибупрофен), если это было необходимо. Оценивались две когорты пациентов: те, кто перенес операции по поводу первичных грыж в марте—октябре 2004 г., и те, кто был прооперирован в те же месяцы в 2005 г. Пациенты оценили степень боли в паху, которую они испытали, посредством использования пакетов визуальных аналоговых шкал (ВАШ). Оценка в 1 балл отражает максимально выраженную боль, которая только мыслима, а 10 баллов — отсутствие боли. Такая же шкала ВАШ была использована для оценки состояния всех пациентов как до операции, так и после нее. В каждой когорте пациенты были разделены на 3 группы в соответствии с уровнем боли спустя 3 мес после операции: те, у кого вообще не было боли (группа А), пациенты с умеренной болью (группа В) и с сильной болью (группа С). Отсутствие боли соответствовало оценке по ВАШ 10 баллам, умеренная боль — 7—9 баллам, а тяжелая боль — 1—6 баллам. В ноябре 2006 г. (т.е. через 12—18 мес после операций в когорте 2005 г. и через 24—32 мес после операций в когорте 2004 г.) пациентам в группе В (с умеренной болью) был отправлен опросник с просьбой сообщить о степени испытываемой боли, используя ВАШ. Тот же опросник был направлен 79 пациентам в группе А (без боли). Эти пациенты были отобраны случайным образом — 40 пациентов из когорты 2004 г. и 39 — из когорты 2005 г. Пациенты в группе С (с сильной болью) также получили этот опросник. В результате в общей сложности 564 пациента, перенесшие операции по поводу первичной грыжи в 2004 и 2005 г., были включены в исследование. Из них 272 были из когорты 2004 г. и 292 — из когорты 2005 г. Когорты были почти идентичны по таким характеристикам пациентов, как пол, двусторонние грыжи, тип грыж и дооперационная оценка боли. Из общего числа пациентов, включенных в исследование (n=564), 464 (82%) не испытывали боль в течение 3 мес (группа А). Группа B (умеренная боль) содержала 42/272 (15%) пациентов из когорты 2004 г. и 49/292 (17%) пациентов из когорты 2005 г. Из 2 когорт (n=564) в общей сложности 9 (1,6%) пациентов сообщили о сильной боли (группа С). Из-за небольшого числа пациентов с сильными болями в группе C аналогичные пациенты из 2 других групп были объединены и анализированы как одна группа. Всего в ноябре 2007 г. были получены 179 анкет. Число ответов в группе А составило 31/39 (79%) и 39/40 (98%) в когортах 2004 г. и 2005г. соответственно.
В группе В число ответов составляло 39/42 (93%) и 41/49 (84%) в когортах 2004 г. и 2005 г. соответственно. Все девять пациентов с тяжелой болью вернули анкеты. Из пациентов группы А (отсутствие боли в течение 3 мес после операции), которые согласились участвовать в анкетировании (n=71), о рецидиве боли с оценкой 7—9 баллов по ВАШ сообщили 11/39 (28%) в когорте 2005 г. (1—1,5 года после операции) и 7/31 (23%) в когорте 2004 г. (2—2,5 года после операции). Ни один пациент не сообщил о сильной боли (1—6 баллов по ВАШ). Из пациентов группы В (умеренная боль через 3 мес после операции) принять участие в анкетировании согласились 80 человек. Об отсутствии дискомфорта сообщили 16/41 (39%) пациентов из когорты 2005 г. (1—1,5 года после операции) и 19/39 (49%) пациентов из когорты 2004 г. (2—2,5 года после операции). Общее число пациентов, которые сообщили о какой-либо степени уменьшения боли или ее отсутствии, составило 20/41 (49%) в когорте 2005 г. и 27/39 (69%) в когорте 2004 г. Об усилении боли по ВАШ до 1—6 баллов сообщили 9/41 (22%) пациентов из когорты 2005 г. и 6/39 (15%) пациентов из когорты 2004 г. Клинически значимые рецидивы были обнаружены у 3 из 15 пациентов, которые отметили усиление боли в периоде с 3-го месяца после операции. Из группы С все 9 пациентов вернули свои анкеты и все сообщили об уменьшении боли, не воспользовавшись ВАШ. Однако только у 1 пациента не было боли в конце исследуемого периода и 1 пациент все еще сообщал о сильной боли.
Это одноцентровое обзорное исследование показывало вариабельность самостоятельной оценки послеоперационной боли в течение первых 32 мес после грыжесечения. Однородные популяции пациентов в двух когортах (2004 и 2005 г.) позволили сравнивать изменения результатов самооценки боли с течением времени. Достаточно важным являлось и изучение боли в течение длительного периода времени после грыжесечения, так как неизвестно, как будет меняться самостоятельная оценка боли у пациентов с различной интенсивностью послеоперационной боли. Три группы пациентов с произвольно выбранными уровнями боли, самостоятельно определенными по ВАШ, были проанализированы в течение 3 периодов после операции, а именно через 3 мес (когда послеоперационная боль, по определению, становится хронической), через 12—18 мес (первый год) и 24—32 мес (второй год) после операции. Это имело большое клиническое значение, так как хроническая боль может указывать на продолжение проблемы в течение неопределенного количества времени, которая не представляется ни отдаленным исчезновением, ни отдаленным появлением послеоперационной боли. Важно также было изучить, как развивается боль в течение 3 мес, для того чтобы сформировать основу для информации об отдельных пациентах и послеоперационного наблюдения. Структура данного исследования позволяла анализировать два временны`х периода после операции и сосредоточиться на относительно небольшом числе пациентов, которые сообщили о послеоперационные боли через 3 мес после операции. Кроме того, большое количество операций было выполнено в одной и той же клинике с использованием идентичных процедур до операции, во время и после нее. При этом 80% всех операций были выполнены одним хирургом, что обеспечивает последовательность в хирургических процедурах и ограничение возможного риска различий в сообщениях о боли пациентами, возникающей вследствие операции. Были использованы три различных методики герниопластики, так как пациенты были отобраны в зависимости от времени выполнения операции, а не от конкретного типа операции, которая им была необходима. Структура исследования не учитывала влияние различных методов герниорафии на оценку послеоперационной боли. Основное внимание исследователей было направлено на изменение уровня боли после операции, а не на влияние различных методов герниопластики на него. Было обнаружено, что некоторые пациенты, которые не испытывали боль через 3 мес после операции, впоследствии сообщили о боли через 1 и 2 года после операции. Большинство пациентов с умеренной болью через 3 мес сообщили о постепенном улучшении через 1 и 2 года после операции. Тем не менее некоторые пациенты сообщили об усилении боли. Таким образом, у пациентов с умеренной болью наблюдалось как улучшение, так и ухудшение. Следовательно, первые 2 года послеоперационного периода после открытого грыжесечения будет наблюдаться очевидный риск развития послеоперационной боли, и пациент с умеренной или сильной болью через 1 и 2 года после операции может попасть в группу лиц с медленно разрешающейся болью или в группу с рецидивами боли.
Этот дуализм отрицательной и положительной динамики послеоперационной боли после грыжесечения указывает на проблему идентификации клинически значимого времени для определения хронической послеоперационной боли. Оценка боли в двух точках времени после операции может совершаться как пациентами, у которых процесс заживления идет медленно, так и пациентами с рецидивами боли. Данное исследование показывало, что в момент времени, более поздний, чем 3 мес после операции, например в течение первого года после операции, одна точка послеоперационной оценки боли добавляла ряд пациентов, которые изначально не испытывали боли, и уменьшала число медленно выздоравливающих пациентов с 3-месячной хронической болью.
Причина дискомфорта или рецидивной боли неизвестна. Это может быть связано с возвратной функцией различных сенсорных нервов, которые были повреждены во время операции, по аналогии с возвращением голосовой функции после повреждения возвратного нерва во время операции на щитовидной железе. Альтернативно, это может быть следствием врастания соединительной ткани в сетку или реакцией организма на инородный предмет. Представляется интересным, что ни один из первоначально не испытывающих боли пациентов, которые позже сообщили о наличии боли, не определили свою боль как сильную по ВАШ, в отличие от определенного количества пациентов, которые сначала имели умеренные боли в течение 3 мес, а затем сообщили о более сильной боли. Однако умеренная боль через 3 мес после операции указывает на риск развития более тяжелых осложнений в течение 2 лет, в отличие от той группы пациентов, которые изначально не испытывали боли, затем начали испытывать умеренную боль. Наличие сильных болей в течение 3 мес после операции влечет за собой более серьезное клиническое значение, так как эти пациенты не смогли излечиться от боли в течение 2-летнего периода наблюдений (кроме одного), и что ухудшение боли от умеренной до тяжелой коррелирует с рецидивом грыж. Число пациентов с сильными болями, у которых не было рецидива боли (2,5%), сопоставимо с относительным числом пациентов с сильной болью (3,6%).
Все усилия хирургов должны быть направлены на понимание причин возникновения данной проблемы у подобных пациентов. Помимо снижения качества их жизни, они несут дополнительные расходы в связи с лечением каузалгий в клиниках и необходимостью проведения еще одной операции. В заключение авторы указали, что послеоперационная боль после открытой герниопластики может либо протекать с отрицательной динамикой, либо появляться в период от 3 мес до 2 лет после операции. Исследование также показало, что пациенты с умеренной болью имеют риск развития тяжелых послеоперационных болевых синдромов, чего не наблюдалось у пациентов, которые первоначально не испытывали боли, но позже стали испытывать умеренные боли. Наконец, большинство пациентов с тяжелой послеоперационной болью на 3-й месяц после операции не могут полностью избавиться от нее в течение первых 2 лет после операции [9].
Особого внимания заслуживает проблема определения и терминологии каузалгии, а также основных постулатов в ее этиологии и профилактики. В 2008 г. в Риме состоялась Международная конференция, в состав которой входили более 200 участников и среди них были 9 международных экспертов в области лечения грыж. По окончанию конференции было представлено руководство по профилактике и лечению хронической послеоперационной боли после герниопластик, а также были созданы единая терминология и определение постгерниоррафической паховой каузалгии.
С целью анализа феномена каузалгии и попытки разработки практических рекомендаций для научного сообщества в 2007 г. была создана рабочая группа из 9 международных экспертов, отобранных на основе их опыта и списков их публикаций по данной проблеме. Эта группа поставила перед собой 6 основных вопросов с 23 разделами, касающихся послеоперационных каузалгий. Встреча по данным вопросам была проведена в Риме 21—22 апреля 2008 г. Конференция была организована в 2 частях: первой была закрытая сессия, зарезервированная для рабочей группы, которая пыталась достичь согласованного мнения по каждому из 6 вопросов, изучаемых в течение предыдущего года. Вторая сессия была открыта для международной аудитории и проводилась в формате обсуждения выводов экспертной группы. В результате был сформулирован ряд положений.
1. Частота развития изнуряющих хронических болей после любой формы открытой или лапароскопической герниопластики, влияющих на нормальную повседневную деятельность или работу, колеблется от 0,5 до 6%.
2. Боль после герниоррафии была определена как боль, возникающая вследствие прямого поражения нерва, возникающая у пациентов, которые не отмечали боль в паху перед операцией. Или, если боль все же отмечалась, то послеоперационная боль значительно отличалась от дооперационной боли. Рабочая группа предложила включить в это определение только хроническую боль, которая наблюдается в течение от 3 мес после операции и длится более 6 мес после операции.
3. Клинический диагноз нейропатической боли не может быть определен в настоящее время.
4. Манипуляции с паховыми нервами во время герниопластики должны быть описаны в протоколе операции с использованием следующей терминологии:
— пересечение нерва означает прерывание хода нервного волокна;
— резекция нерва, или нейрэктомия, означает иссечение сегмента нерва вдоль пахового канала.
5. Результаты опроса международной аудитории показали, что идентификация в ходе выполнения герниопластики подвздошно-паховой, подвздошно-подчревной и половой ветвей бедренно-полового нерва представляется возможной лишь в 40% случаев. Однако рабочая группа, напротив, в соответствии с данными международной литературы считает, что идентифицировать все 3 ветви в виде отдельных нервов можно у 70—90% пациентов.
6. Как рабочей группой, так и международной аудиторией даны рекомендации по выявлению и сохранению всех 3 паховых нервов, потому что согласно данным современной литературы это уменьшает риск возникновения послеоперационных хронических болей. Однако в случае, если нерв в ходе операции все же был поврежден, или, по крайней мере, есть подозрение на это, по единогласному мнению рекомендовано полностью удалять его, но признано недопустимым просто иссечь часть нерва, оставив его культи в операционном поле.
7. Отсутствовало единое мнение о влиянии шовного клея на интенсивность хронической боли.
8. Рабочая группа рекомендовала тройную нейрэктомию в случае, если лечение хронической послеоперационной боли неэффективно более одного года [10].
Как видно из результатов конференции, особое внимание было уделено проблеме вовлечения паховых нервов в этиологию каузалгий. На фоне заинтересованности этим фактом в 2010 г. было выполнено исследование по изучению проблемы невритов при герниопластиках. У 90 пациентов было выполнено 100 паховых герниопластик, во время которых было предположено 34 случая повреждения нервных стволов. Экспериментальная аудитория состояла в основном из мужчин — представителей европеоидной расы в возрасте от 25 до 35 лет, у которых не было зафиксировано случаев деформации позвоночника, и из 3 женщин с открытой гистерэктомией в анамнезе.
В общей сложности было удалено 84 нерва (73 подвздошно-паховых, 9 бедренно-половых, 2 подвздошно-подчревных) по разным причинам. Другими словами, в 34% от всех герниопластик у данных пациентов были зафиксированы случаи пахового неврита. Из них неврит подвздошно-паховых нервов был в 30 (88%) из 34 случаев, что является самой высокой заболеваемостью среди трех нервов. Местами локализации невритов были область прохождения нерва через наружную косую мышцу живота (83%), область дистальной бифуркации нерва (11%), область трифуркации нерва (3%), а также треугольник Хессельбаха (3%). Один нерв, подозреваемый в наличии неврита, был позже на основании результатов гистологического исследования признан нормальным. Таким образом, случаи невритов были точно определены хирургом в 33 случаях из 34. В случае панталонных грыж заболеваемость невритом составила 47%, что выше, чем заболеваемость среди косых и прямых грыж (32 и 30% соответственно). Паховый неврит на левой стороне тела возникал в 2 раза чаще, чем на правой. Таким образом, можно утверждать, что заболеваемость невритом паховых нервов составляет от 30 до 46%. Подобные данные не были ранее описаны в научной литературе и могут представлять собой смену парадигмы в понимании предоперационных и послеоперационных болей при паховых грыжах. С методикой выполнения герниопластики по Лихтенштейну связаны 12% всех случаев постгерниорафических казуалгий и высокая частота пересечения паховых нервов во время операции, а также прилегание 3 вышеописанных нервов к имплантату. Попытки уменьшить частоту каузалгий при операции Лихтенштейна привели всех авторов к необходимости рекомендовать к выполнению при данной герниопластике стандартный лизис подвздошно-пахового нерва. Два автора провели проспективное рандомизированное исследование, что позволило одному из них снизить частоту возникновения болей с 28 до 8%, а другому — с 21 до 6%. Третий автор провел ретроспективное исследование, что позволило снизить процент болей с 26 до 3%. Однако в других сериях исследований не выявлено ни улучшения, ни ухудшения результатов. Это позволяет предположить, что лизис подвздошно-пахового нерва не наносит ощутимого вреда [11].
S. Alfieri и соавт. [12] в проспективном многоцентровом исследовании показали, что частота возникновения послеоперационных болей при удалении всех 3 нервов достигает 40%, и это указывает на принцип «больше не значит лучше». В свете данных исследований частота развития подвздошно-бедренных невритов указывает на то, что удаление подвздошно-пахового нерва в данных случаях вполне обосновано.
Впоследствии было проведено множество исследований, цель которых состояла в выявлении связи между наличием непосредственно самого синтетического имплантата с феноменом каузалгии после герниопластик.
M. Bay-Nielsen и соавт. [13] сообщили о 37% частоте формирования хронической боли после паховых герниопластик. Они не привели никаких различий в отношении видов грыж, хирургических методов или типов анестезии.
Однако, несмотря на то что С. Heise и соавт. [7] в 1998 г. ввели термин «mesh inguinodynia», они все же сомневались, действительно ли имплантаты вызывают болевые синдромы или же наоборот, помогают их устранить. Свое исследование авторы провели на 117 повторно оперированных пациентах. Из них у 20 была выполнена первичная аллогерниопластика и у 3 — лапароскопическая. Двум пациента потребовалось удаление сетки через 1 и 2 года после операции, 16 пациентам потребовалось удаление сетки в совокупности с удалением подвздошно-пахового и подвздошно-подчревного нерва. У пациентов, перенесших удаление сетки и нейрэктомию, частота отличных результатов (62%) была выше, чем у пациентов, которые перенесли лишь удаление сетки (50%) [7].
За последние 5 лет в Финляндии проведен общенациональный анализ осложнений, связанных с хирургией паховых грыж, который включал анализ результатов 55 000 герниопластик. Открытый способ аллогерниопластики был наиболее частой операцией за последние 5 лет. Согласно результатам исследования 2/3 послеоперационных осложнений были связаны с хронической болью и инфекцией. Большинство обследованных составили пациенты, работа которых была связана со значительными физическими нагрузками, и пенсионеры. Частота развития осложнений при герниопластике по Лихтенштейну оказалась ниже на 3,9%, чем при использовании других методик. Был сделан вывод, что хронические боли в послеоперационном периоде развились у 33% пациентов, которым была выполнена открытая герниопластика, и у 20% пациентов, перенесших лапароскопическую герниопластику. Удивительно, что в итоге хроническая невропатическая боль была у 47% пациентов. Исследование показало, что внедрение сетчатого имплантата вызывало боль в 7 раз чаще, чем операции с использованием собственных тканей пациентов. Эта группа финских исследователей использовала 24 различных типа имплантатов, в том числе легкие, тяжелые и частично рассасывающиеся. Был отмечен одинаковый процент осложнений для каждого подтипа сетки.
Кроме того, в рамках этого же исследования было определено, что к причинам каузалгии в послеоперационном периоде относятся общая анестезия, большая длительность операции, раневая инфекция и кровотечения. Операции по удалению имплантата и орхиотомия не ликвидировали каузалгию. Большинство осложнений были связаны с первичными плановыми герниопластиками и открытым методом их выполнения. В этом исследовании наибольшее количество осложнений наблюдалось после лапароскопической герниопластики. Никакие конкретные виды сетки не были главными причинами боли. Исследователи пришли к выводу, что сетчатые имплантаты не увеличивают частоту хронической боли, однако распространенность таких факторов, влияющих на возникновение хронической боли, как уровни предоперационной боли, возраст моложе 40 лет, боли в других местах (например, в спине), психосоциальные расстройства, а также тяжелый физический труд в рабочем анамнезе, была повышенной [14].
Исследование, проведенное U. Fränneby и соавт. [15], показало, что лапароскопическая герниопластика вызывает каузалгию как тотчас после операции, так и в отдаленном периоде. Методики Шолдиса, Лихтенштейна и другие виды герниопластик давали весьма схожие результаты. Эти результаты в основном показывают, что сетчатый имплантат не является причиной увеличения частоты возникновения или интенсивности хронической боли в послеоперационном периоде.
Другая группа зарубежных авторов [16] пришла к выводу, что высокие уровни послеоперационной боли имелись у пациентов, у которых наблюдалась сильная боль в 1-ю неделю после операции. Кроме того, такие же высокие показатели хронической боли наблюдались у пациентов, перенесших рецидив грыжи, и у пациентов, у которых наблюдалась весьма сильная боль до операции. Эти исследователи заключили, что хроническая боль возникает реже после открытой и лапароскопической аллогерниопластики по сравнению с герниопластиками с использованием собственных тканей пациентов.
S. Nienhuijs и соавт. [17] определили такие факторы риска развития хронической послеоперационной боли, как молодой возраст (моложе 40 лет), боязнь боли пациента перед операцией, и то, что региональная анестезия снижала уровень боли только в течение первого дня после операции. Эта же группа исследователей пришла к выводу, что только у 11% пациентов, перенесших операцию по поводу паховой грыжи, развилась хроническая боль, у 3% пациентов наблюдались боли нейропатического происхождения от умеренной до сильной.
H. Paajanen [18] в одном из своих исследований уделил большое внимание тому, что хроническая боль проявлялась реже после открытых и лапароскопических аллогерниопластик, по сравнению с операциями без использования сеток. Он также подтвердил аналогичные выводы других исследователей по поводу списка факторов, определяющих хроническую каузалгию. Среди них была общая анестезия и послеоперационные кровотечения. В дальнейшем автор доказал, что легкие сетки реже вызывают послеоперационные боли; служат причиной более высокой частоты рецидивов; улучшают половую функцию (по сравнению с другими видами сеток) [18].
М. Kalliomäki и соавт. [19] рассмотрели результаты герниопластик, выполненных 2834 пациентам, и определили следующие факторы увеличения послеоперационной боли: открытый метод операции; наличие предоперационной боли; период менее 3 лет с момента последней операции; тип хирургической процедуры; опыт хирурга, а также наличие разнообразных послеоперационных осложнений. Эта группа исследователей решительно заявила, что использование синтетической сетки снижает риск рецидивов грыж и хронической боли [19].
Исходя из проблемы этиологии послеоперационных каузалгий, следует обратить внимание на результаты исследования методики безфиксационной аллогерниопластики M. García Ureña и соавт. [20], которые в 2011 г. протестировали новую самофиксирующуюся полипропиленовую сетку из легких материалов. В исследовании принимало участие 10 медицинских центров. В исследование были включены только пациенты с первичными неосложненными грыжами. Сетка была размещена в соответствии с методикой Лихтенштейна без какой-либо фиксации. Больных анкетировали в 1-ю неделю, а также в 1, 3 и 6-й месяцы послеоперационного периода. Основная цель исследования заключалась в оценке максимальной боли в послеоперационном периоде, на сроке после 6 мес. Боль оценивали по ВАШ. В общей сложности были прооперированы 256 пациентов. Средняя длительность операции составила 35,6 мин, 76,2% пациентов были оперированы в амбулаторных условиях. Результатами были несколько видов послеоперационных осложнений: в 2% — раневые инфекции, в 17% — серомы, в 21% — гематомы, в 6% — орхиты. Острая каузалгия отмечалась в 27,3% случаев в 1-ю неделю и 7,5% — в 1-й месяц послеоперационного периода, хроническая каузалгия наблюдалась в 3,6% случаев на 3-м месяце и в 2,8% — на 6-м месяце. Рецидивы и долгосрочные осложнения отсутствовали. Авторы исследования сделали заключение, что данный тип сетчатого имплантата может успешно и безопасно использоваться в случае первичных неосложненных паховых грыжах. Кроме того, в большинстве случаев герниопластики с использованием самофиксирующихся имплантатов может быть выполнено в амбулаторных условиях. Наличие хронической каузалгии было зафиксировано меньше чем в 3% случаев [20].
Согласно данным J. Mazin [6] в настоящее время нет окончательного ответа на вопрос о влиянии сетчатого имплантата на частоту развития каузалгий, так как данные слишком противоречивы. Другой проблемой, которая обсуждалась автором, явилось происхождение или механизм возникновения боли, обусловленной наличием сетки. Были определены 5 основных факторов, вызывающих боль: 1) сетки из тяжелых материалов; 2) индивидуальный у каждого пациента процесс образования послеоперационного рубца; 3) ситуация, при которой хирург уделяет недостаточное внимание к техническим деталям имплантации сетки; 4) аллергические реакции на материалы сетки, такие как полипропилен и полиэфир; 5) прямое или косвенное повреждение нерва или воспаление окружающих нервов.
Таким образом, J. Mazin [6] выделяет основные рекомендации по уменьшению возможности возникновения послеоперационной каузалгии. Он настоятельно рекомендует применение именно легких сеток при герниопластиках. Для варианта с использованием лапароскопической техники для выполнения операции рекомендуется применять безфиксационные методики размещения имплантата. В рамках стандартной техники любые швы или скобы должны накладываться только при прямой их визуализации, в сочетании с точностью и осведомленностью относительно окружающих анатомических структур, особенно нервов. Важно определить индивидуальную чувствительность пациента к тому или иному синтетическому материалу. Непрерывное внимание к техническим и анатомическим деталям во время операции имеет первостепенное значение. Хирург должен избегать размещения сетки в области заведомо дефектных тканей. Это относится к инфицированным или воспаленным тканям. Наконец, хирург должен адаптировать процедуру для каждого конкретного пациента, а не наоборот, пациента к процедуре. В хирургии грыж нельзя использовать одни и те же технические процедуры у всех пациентов. Различные пациенты нуждаются в различных оперативных методиках и в применении различных видов имплантатов. Использование одного и того же технического подхода для всех пациентов является весомой причиной для возникновения послеоперационной каузалгии [6].
Проведенный анализ данных литературы позволяет сформулировать несколько положений:
— анатомия паховой области остается очень сложной, а сама паховая область одной из наиболее трудных для ориентации в ходе операции анатомических областей тела человека;
— исключительное внимание хирурга к мельчайшим деталям оперативной техники и анатомическим особенностям является залогом положительного результата хирургического лечения грыж;
— точный индивидуальный выбор техники герниопластики (конечно, с некоторой стандартизацией) должен осуществляться для каждого пациента;
— в настоящее время отсутствует «золотой стандарт» методики паховой герниопластики, позволяющий предотвратить развитие каузалгии у пациента, равно как и «идеальный» имплантат, и методика фиксации последнего.
Как ухаживать за раной, когда сняли швы после операции?
Нелишним будет напомнить, что швы должен снимать исключительно специалист – врач или медсестра. Выполнять данную процедуру самостоятельно строжайше запрещено, из-за высокого риска занести инфекцию в рану или спровоцировать кровотечение.
Обработка места разреза после снятия швов осуществляется теми же средствами, что и до этого. Лечебные процедуры длятся до полного заживления раны. Обычно на это уходит около 1 недели.
Профессиональный уход за послеоперационными швами в «МЦ Столетник»
Если в любых вопросах, связанных с заботой о собственном здоровье, вы предпочитаете доверяться профессионалам, вас ждут в медицинском . В помощь тем, кто не уверен, как правильно ухаживать за швом после операции, широкий спектр послеоперационных услуг. В их числе:
- перевязка большая и малая;
- снятие швов до 5 см;
- снятие швов 5–10 см;
- снятие швов более 10 см;
- санация раневой поверхности;
- иссечение рубцов;
- и многое другое.
Ответственность и высокий профессионализм сотрудников клиники – залог безопасного и скорейшего выздоровления наших пациентов. А ценовая доступность предоставляемых услуг избавит от необходимости тратить время и нервы на походы в поликлинику. Записывайтесь на процедуры по телефону: +7 (8412) 999-395, 76-44-20. Ждем вас по адресу: г. Пенза, ул. Чаадаева, 95 (микрорайон Шуист).
Литература
- Беляев А. Н., Козлов С. А., Таратыков И. Б., Новиков Е. И. Уход за больными в хирургической клинике: учеб. пособие. – Саранск: Издательство Мордовского университета, 2003. – 136 с.
- Буянов В. М. Егиев В. Н. Удотов О. А. Хирургический шов. – М.: Антис, 2000. – 92 с.
- Золтан Я. Операционная техника и условия оптимального заживления раны. – Будапешт: Издательство АН Венгрии, 1983. – 175 с.
- Миронова Е. Н. Основы физической реабилитации. – М.: МОО «Академия безопасности и выживания», 2016 – 310 с.
- Семенов Г. М., Петришин В. Л., Ковшова М. В. Хирургический шов – СПб.: Питер, 2001. – 256 с.
Автор: Королёв Е. С.
Рецензент: врач-рефлексотерапевт Курусь А. Н.