Базальноклеточный рак (базалиома) — это наиболее распространенный вид рака кожи. Произрастает он из клеток эпидермиса под названием кератиноциты, которые располагаются вблизи базального слоя дермы. Опухоль растет крайне медленно и практически не дает метастазов, поэтому ее называют полузлокачественной. Тем не менее, базалиома характеризуется инфильтративным ростом, поэтому может проникать в подлежащие ткани. При сильной деструкции и упорных рецидивах, базальноклеточный рак кожи дает метастазы и может привести к гибели пациента.
- Причины возникновения злокачественных новообразований кожи
- Виды базальноклеточного рака кожи
- Симптомы рака кожи
- Методы диагностики базальноклеточной опухоли кожи
- Методы лечения базальноклеточного рака кожи
- Вероятность рецидивов базальноклеточного рака
- Прогноз и профилактика базальноклеточного рака
- Смежные операции и методики
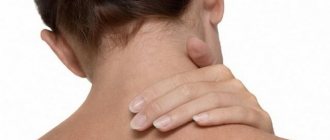
Обычно базалиома возникает у людей со светлой кожей на открытых для инсоляции участках тела (лицо и кисти рук).
В области головы и лица базалиома обычно локализуется на естественных складках:
- Крылья носа.
- Носогубные складки.
- Губы и уголки рта.
- Уголки глаз.
Причины развития заболевания
В настоящее время нет однозначного ответа на вопрос от чего бывает рак кожи. Как и многие другие онкологические заболевания, опухоль кожи считается полиэтиологичной патологией. Существует несколько предрасполагающих факторов, наличие которых увеличивает риск возникновения опухолевого очага. К ним относятся:
- Чрезмерное воздействие ультрафиолетовых лучей на кожу. Подобная ситуация возникает при длительном и частом нахождении под солнечными лучами, посещении солярия, работы на улице. Жители Южных регионов находятся в группе риска развития рака кожи.
- Наличие светлой кожи. Недостаток выработки меланина увеличивает возможность возникновения опухоли кожных покровов.
- Ожог кожи. Высокая степень ожога сопровождается рубцеванием кожных покровов. Этот процесс способствует возникновению скрытого канцерогенеза.
- Облучение. Воздействие радиоактивных, ионизирующих лучей обладает пагубным воздействием на кожные покровы. Увеличивается риск образования лучевого дерматита.
- Наличие контакта кожи с токсическими веществами. К данной группе канцерогенов относятся мышьяк, алюминий, титан, никель и другие тяжелые металлы.
- Иммунодефицит. Состояния, при которых происходит снижение защитных функций организма, предрасполагают к формированию опухолевого очага.
- Возраст. Наиболее часто опухолевый процесс кожи поражает людей, чей возраст старше 50 лет.
- Сопутствующие системные заболевания. Врачи выделяют группу патологий, при которых риск развития рака кожи значительно увеличивается. К их числу относятся системная красная волчанка, лейкоз, хронические заболевания кожных покровов.
- Наследственность. Наличие опухоли кожи у предыдущих поколений родственников не является основным фактором риска. Однако отягощенная наследственность в совокупности с другими предрасполагающими состояниями увеличивает возможность развития рака кожных покровов.
- Нанесение татуировок. В данном случае имеется два фактора риска. Это нарушение целостности кожи и введение краски с канцерогенными веществами. Дешевые чернила для тату могут содержать в себе примеси алюминия, титана, мышьяка.
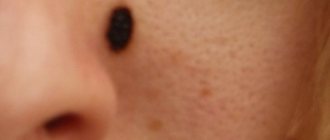
- Большое количество невусов. Врачи призывают следить за состоянием родинок и при малейших изменениях обращаться к специалистам. Травматизация невусов повышает возможность развития рака кожных покровов.
- Чрезмерное употребление алкоголя, курение. Хроническая интоксикация оказывает пагубное воздействие на организм в целом. На этом фоне риск формирования опухолевого процесса увеличивается в несколько раз.
- Употребление в пищу продуктов с высоким содержанием нитратов.
Прогноз и профилактика базальноклеточного рака
Крайне медленный рост опухоли и низкая вероятность метастазирования базальноклеточного рака дают хороший прогноз в плане полного выздоровления. Метастатические формы базалиомы встречаются крайне редко, поэтому говорить о точных прогнозах выживаемости здесь сложно. По данным мировой литературы средняя продолжительность жизни таких больных составляет 4,5 года.
Профилактика кожной базалиомы предполагает регулярные защитные мероприятия против агрессивного воздействия канцерогенных факторов:
- Не подвергайте кожу прямой солнечной инсоляции. Как минимум, используйте кремы с солнцезащитными свойствами. Не злоупотребляйте загаром и посещением солярия.
- При работе с химическими раздражителями на вредных условиях производства пользуйтесь индивидуальными средствами защиты — одежда, перчатки, маски.
- Не пренебрегайте средствами защиты и при работе с бытовой химией.
Чтобы вовремя обнаружить рак на коже и провести лечение с наименьшими потерями, рекомендуется ежегодно проходить профилактические осмотры с использованием дерматоскопии.
В «Евроонко» эта процедура проводится с помощью специальной немецкой технологии ФотоФайндер. Она предполагает составление карты родинок и новообразований всего тела с последующим отслеживанием динамики их изменения. Разрешение оптической системы позволяет визуализировать кожные новообразования размером всего 0,9 мм.
При обнаружении базальноклеточного рака мы используем методы лечения, рекомендованные современными протоколами. Они дают хорошие клинические и косметические результаты. При возникновении вопросов свяжитесь с нашими специалистами.
| Стоимость : | |
| Консультация онколога | 5 100 руб. |
| Дерматоскопия | 4 600 руб. |
| Гистологическое исследование | 5 200 руб. |
| ФДТ без стоимости контраста | 39 600 руб. |
Запись на консультацию круглосуточно
+7+7+78
Виды
Новообразования кожи подразделяют на три вида: доброкачественные, пограничные или предраковые опухоли и злокачественные. Все они различаются способностью давать метастазы в другие органы, осложнениями, а также способностью приводить к летальному исходу. Необходимо добавить, что большое количество родинок на коже или других новообразований доброкачественной природы (папилломы, бородавки) является свидетельством наличия предрасположенности данного человека к онкозаболеваниям. Доброкачественными новообразованиями считаются:
- родинки или невусы;
- атеромы;
- аденомы;
- лимфангиомы;
- гемангиомы;
- фибромы;
- нейрофибромы;
- липомы;
- папилломы.
К пограничным опухолям можно отнести:
- кератоакантому;
- старческую кератому;
- кожный рог;
- пигментную ксеродерму и другие не особо распространенные новообразования.
Злокачественные новообразования представлены меланомой, саркомой, эпителиомой, базалиомой.
При общем осмотре пациента врач-онкодерматолог
Смотрит ВСЕ! Кожу на туловище, лице, шее, конечностях, слизистые, волосистую часть головы.
- Дерматоскопом.
- СИАскопически.
- Цитологически.
- Гистологически!!
Биопсия новообразования кожи
Обязательным диагностическим этапом при новообразованиях кожи является морфологическая верификация процесса, для этого проводится биопсия
. Врач-онколог забирает клетки или ткани в месте поражения опухоли и передает их на исследование патоморфологам, которые формируют свое заключение.
В морфологическом заключении содержатся сведения об опухоли:
- локализация процесса (где находится опухоль);
- диаметр (какой размер опухоли);
- тип роста;
- характеристика края резекции (опухоль удалена полностью или нет).
Врач-онколог выставляет окончательный диагноз и формирует план лечения только после получения результатов выполненной биопсии.
Доброкачественные новообразования кожи
Доброкачественные новообразования обладают медленными темпами роста, в процессе развития они давят на близкорасположенные ткани, однако в них не проникают. Доброкачественные новообразования следующие:
- Липома представляет собой новообразование из жирового слоя;
- папилломы и бородавки. Внешне похожи на наросты на ножке (при травмировании часто переходят в рак) или выпуклости, происхождение – вирусное;
- Дерматофиброма развивается из соединительной ткани. Чаще всего выявляется у представительниц прекрасного пола в молодом и зрелом возрасте. Отличительными особенностями являются небольшой размер (0,3-3 см), медленный рост, несущественные субъективные ощущения. В основном поражает нижние конечности. Дерматофиброму следует отличать от невуса, базалиомы и дерматофибросаркомы;
- Невусы — это различные резко ограниченные гиперпигментированные участки кожи, имеющие различную форму и цвет. Поверхность – как полосатая, так и ровная. Могут наблюдаться бородавчатые разрастания невуса, достигающие двух сантиметров в диаметре. Отличить их от мягких фибром можно по имеющимся на поверхности гиперкератотическим наслоениям (плотные корочки, напоминающие шелушение). Наиболее опасным представителем считается пигментный пограничный невус, в котором присутствует меланин и который может переродиться в меланому;
- Лентиго возникает, как правило, в подростковом периоде на любом участке тела. Внешне выглядит, как гладкое овальное пятно, диаметр которого может доходить до полутора сантиметров. Если данное новообразование возникает в пожилом возрасте, то его называют старческим лентиго;
- Атеромы развиваются из сальной железы. Атерома или эпителиальная киста имеет высокую способность к озлокачествлению в липосаркому. Чаще всего возникает на участках кожи, где сконцентрировано множество сальных желез (кожа головы, лицо, лоб). Это одиночное безболезненное образование, возвышающееся над поверхностью. В случае воспаления и начале процесса нагноения кожа становится красной, при этом возникают болевые ощущения;
- Гемангиома. Существует капиллярная и кавернозная гемангиома. Капиллярная может достигать значительных размеров, а кавернозная, несмотря на более глубокое расположение, больших размеров не достигает. Цвет опухоли зависит от структуры и может варьироваться от красного до синюшно черного оттенка. Показано хирургическое лечение с иссечением опухоли и подлежащих слоев.
На данный момент различают две наиболее распространенных формы: поверхностная и узловая
Поверхностный (впервые выявленный) БКРК:
- чаще развивается на коже туловища и конечностей;
- реже: головы и шеи;
- у пациентов более молодого возраста, с преобладанием женщин.
Важно!
Основной фактор развития — генетический — это наследственная мутация, которая передается потомкам или возникает в связи с экологическим или иным неблагоприятным воздействием внешней среды.Узловая форма (впервые выявленная) БКРК:
- чаще развивается на коже головы
- у пациентов пожилого и старческого возраста
Удаление доброкачественных опухолей кожи
Удаление доброкачественных новообразований кожи необходимо проводить для устранения косметического дефекта, предотвращения сдавления соседних структур и постоянного повреждения.
Оперативное удаление проводится разными способами:
- Классический метод (скальпелем);
- Электрокоагуляция;
- Радиоволновой метод;
- Лазерный метод и др.
Как правило, предпочтение отдается лазерному и радиоволновому методам, так как они наименее травматичны и имеют самый низкий показатель рецидивов.
Выбор метода лечения необходимо проводить только после тщательного обследования и учитывая все индивидуальные особенности пациента.
Предраковые новообразования кожи
Предраковые состояния кожи делят на две основные группы: факультативные, риск озлокачествления которых минимален, и облигатные — предраки, которые, в конечном итоге, обязательно станут онкозаболеваниями.
К предраковым состояниям кожи относятся:
- Пигментная ксеродерма. Данная опухоль развивается вследствие чрезмерной чувствительности кожи к солнечной энергии, в результате кожа теряет свойства к регенерации. Заболевание носит врожденный характер, диагностировать его легко у детей первого года жизни по обилию веснушек на поверхности кожи, которая чаще всего подвергается солнечному излучению. Практически в каждом случае данного заболевания возникает клеточный и плоскоклеточный рак. Очень высокая смертность у людей до двадцати лет с таким заболеванием;
- Кондилома Бушке-Левенштейна, возбудителем которой считается вирус папилломы человека. Данное новообразование обладает бурным ростом, огромными размерами, а также выделяет мутную жидкость с неприятным запахом. Подобное заболевание характеризуется прогрессирующим течением, склонно к прорастанию в близкорасположенные ткани и способно возникать вновь даже после полного хирургического удаления. Кроме того, состояние быстро переходит в плоскоклеточный рак кожи;
- Старческая кератома или старческий кератоз (или солнечный). Как правило, возникает у людей пожилого возраста. Внешне данное состояние выглядит в виде оранжевых или желтых высыпаний на коже размером не более одного сантиметра в диаметре. В дальнейшем на месте высыпаний формируются чешуйки и сухие корки, при механическом отслаивании которых наблюдается небольшая кровоточивость. Если в основании новообразования появляется уплотнение, считается, что это начало озлокачествления опухоли. Но такое явление наблюдается достаточно редко;
- Болезнь Педжета. После 42 лет у женщин вокруг соска и на нем могут наблюдаться участки покраснения со скоплением биологической жидкости, признаками шелушения, мокнутия. Затем на этом участке формируются корки, наблюдается втяжение соска. Развитие данного заболевания может занимать годы. По мнению некоторых онкологов, это состояние является развитием рака на начальной стадии;
- Кожный (старческий) рог. Данное заболевание наблюдается обычно в глубоко пожилом возрасте. Возникает также на открытых участках кожи, которые постоянно сдавливаются или подвержены трению. Первичный кожный рог возникает на здоровой коже, тогда как вторичный после некоторых заболеваний (к примеру, красная волчанка, солнечный кератоз). По окончании своего формирования опухоль имеет вид конусообразного рогового образования, длина которого значительно больше диаметра его основания. Данное заболевание характеризуется длительным течением и имеет склонность к озлокачествлению.
Мнение эксперта
Автор:
Алексей Андреевич Моисеев
Заведующий онкологическим отделением, врач-онколог, химиотерапевт, к.м.н.
Каждый год на территории России регистрируется 9000 случаев впервые выявленной меланомы. Это агрессивная злокачественная опухоль является причиной летального исхода 40% пациентов. Подобная статистика свидетельствует о том, что население страны недостаточно осведомлено о симптомах меланомы. В результате обращение к врачу происходит на поздних стадиях, когда лечение считается малоэффективным.
Врачи Юсуповской больницы определяют локализацию меланомы и назначают соответствующее стадии развития опухоли лечение. Индивидуальный подход к проблеме каждого пациента позволяет снизить количество летальных исходов. Вовремя обнаруженная опухоль характеризуется благоприятным прогнозом для выздоровления. Чем позже выявлена меланома, тем длительнее будет процесс лечения. Его успешность зависит от многих факторов. Основными способами лечения меланомы являются операция, лучевая и химиотерапия. В зависимости от состояния проводится симптоматическая терапия.
Предположить наличие рака кожи можно самостоятельно в домашних условиях. Врачи рекомендуют регулярно осматривать кожные покровы, особенно невусы, на предмет появления патологических образований.
Вирус папилломы человека и цервикальная интраэпителиальная неоплазия: лечить или не лечить?
10Сен 2020
Роговская С.И., Короленкова Л.И. Вирус папилломы человека и цервикальная интраэпителиальная неоплазия: лечить или не лечить? // Женское здоровье и репродукция: сетевое издание. 2022. № 11 (42) — № 12 (43). URL: https://journal.gynecology.school/statyi/virus-papillomy-cheloveka-i-cervikalnaja-intrajepitelialnaja-neoplazija-lechit-ili-ne-lechit/(дата обращения: дд.мм.гггг)
Во всем мире и в частности России отмечается заметный рост частоты инфицирования ВПЧ [1, 2]. ВПЧ способен вызывать пролиферацию и малигнизацию эпителия кожи и слизистых оболочек [3]. ВПЧ разделяется на типы с низкой онкогенностью, вызывающие доброкачественные новообразования (папилломы, кондиломы и аногенитальные бородавки), и высокой онкогенностью, инициирующие рак ряда органов [4, 5]. За открытие роли ВПЧ высокого канцерогенного риска (ВПЧ ВКР) в возникновении некоторых видов рака, в том числе рака шейки матки (РШМ), немецкому ученому Харальду цур Хаузену присуждена Нобелевская премия по физиологии и медицине в 2008 году. В настоящее время роль ВПЧ в возникновении предраковых процессов и РШМ общепризнана [6–8].
К облигатному предраку относятся тяжелые плоскоэпителиальные повреждения (high grade squamous intraepithelial lesions, HSIL) — цервикальные интраэпителиальные неоплазии (CIN), включающие CIN II (умеренную дисплазию) и CIN III (тяжелую дисплазию и преинвазивный рак — carcinoma in situ, CIS).
Онкогенный потенциал ВПЧ детерминирован хорошо изученными механизмами. Белки — продукты ранних генов ВПЧ E6 и E7 — стимулируют пролиферацию клеток, приводят к нарушению процессов апоптоза и нарушению защитных регуляторных механизмов, обеспечивающих репарацию ДНК, что способствует дестабилизации генома и появлению морфологически атипических клеток [8–10]. Изучение типов ВПЧ ВКР у ВИЧ-инфицированных и ВИЧ-негативных женщин показало, что наиболее распространенные типы ВПЧ, в первую очередь 16-й типа, у ВИЧ-негативных женщин могут обладать большей способностью избегать иммунного надзора, чем другие типы [11].
Дополнительные факторы риска развития CIN на фоне ВПЧ не уточнены. Большинство исследователей рассматривают как важную причину неоплазии длительное хроническое воспаление в слизистой оболочке, вызванное различными инфекциями, повторными травмами, химическими и термическими раздражителями. Например, микоплазменная и хламидийная инфекции расцениваются как предрасполагающие факторы канцерогенеза РШМ.
Показано, что наличие внутриклеточных возбудителей способствует ко-инфициированию ВПЧ; отмечается их онкогенный синергизм; острое воспаление нередко не излечивается, переходя в хроническую фазу [12, 13]. При хроническом воспалении, синхронном с ВПЧ-инфицированием, происходят постоянный выброс про- и противовоспалительных цитокинов, накопление липидов в клетках, нарушение внутриклеточного баланса и т. п., что в итоге приводит к нестабильности генома и развитию неоплазии. На фоне хронического воспаления в эпителии накапливаются токсические продукты и появляются клетки с признаками атипии [14, 15].
Поскольку причиной РШМ объективно является длительная персистенция ВПЧ онкогенных типов, естественное течение заболевания до инвазии предусматривает многолетнюю (8–10 лет) стадию в виде интраэпителиального поражения CIN II–III/CIS, а шейка матки легко доступна для профилактических, диагностических и лечебных вмешательств, становится ясно, что специалистам предоставлена возможность не допустить развития инвазивной карциномы и излечить неопластический процесс на стадии предрака — CIN. Однако тактика не всегда понятна практическому врачу, особенно в случаях, когда обнаруживаются признаки CIN I–II, аномальные цервикальные мазки неясной степени или имеется расхождение результатов диагностических тестов.
Российские рекомендации 2022 года «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака» (письмо МЗ РФ от 02.11.2017 г.) призваны помочь клиницистам в этом [16]. Документ содержит современные рекомендации по классификации, диагностике и лечению предраковых цервикальных заболеваний, ключевые положения которых обобщены ниже.
В соответствии с обновленными клиническими рекомендациями [16], к предраковым состояниям шейки матки относят CIN, которые имеют вероятность регрессии, стабильного течения и прогрессии до следующей степени и далее до инвазивного рака в течение нескольких лет или десятилетий. При этом вероятность регрессии тем ниже, чем больше степень CIN. Чаще CIN I у молодых женщин может регрессировать вследствие спонтанной элиминации ВПЧ. Эта неоднозначность течения процесса обусловливает трудности в составлении алгоритма врачебной тактики у некоторых групп женщин при скрининге и в клинической практике.
Диагностика вируса папилломы человека и цервикальной интраэпителиальной неоплазии
В раннем выявлении предраковых состояний ключевую роль отводят скринингу. Отмечают, что он должен охватывать минимум 70% целевой популяции, чего можно добиться с помощью рассылки приглашений на обследование посредством электронной почты и мобильной связи, а также благодаря использованию технологии самозабора материала. Порядок скрининга рекомендуют следующий [16].
Целевая аудитория — женщины 21–69 лет (после этого периода жизни регулярное наблюдение прекращают при условии предыдущего адекватного скрининга и при отсутствии в течение 20 лет CIN II и более тяжелых поражений). В возрастной группе 21–29 лет рекомендуют проводить цитологическое исследование минимум каждые 3 года. У женщин 30–69 лет цитологическое исследование дополняют ВПЧ-тестом; при этом обследование проводят минимум каждые 5 лет. Данная стратегия не укладывается в стандарты Приказа № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)» (в практике это основной документ, регламентирующий деятельность акушера-гинеколога), в соответствии с которым «мазок на онкоцитологию» следует брать ежегодно, а ВПЧ-тест и вовсе не предусмотрен в рамках ОМС в качестве скринингового метода. Клиницист может лишь посоветовать пациентке пройти комбинированное обследование за свой счет, объяснив, что это, во-первых, отвечает требованиям современных рекомендаций, во-вторых, экономически выгодно, поскольку в случае отрицательных результатов обоих тестов его достаточно проходить 1 раз в 5 лет.
При патологических мазках или выявлении персистирующей ПВИ рекомендована кольпоскопия. Однако наличие или отсутствие воспалительного процесса может существенно менять картину и делает метод достаточно субъективным. Визуальные картины зависят от этапа воспалительного процесса. Так, острый цервицит сопровождают отечность слизистой оболочки, ее гиперемия, подверженность травмированию при контакте. После обработки раствором уксусной кислоты поверхность слизистой оболочки шейки матки нередко бледнеет. При очаговом цервиците на фоне гиперемии выделяют участки с приподнятыми краями и очаговыми скоплениями мелких красных точек (именно так выглядят при кольпоскопии кольцевые петли расширенных субэпителиальных капилляров).
Хроническое воспаление практически не имеет специфической картины: отмечают локальную атрофию многослойного плоского эпителия, очаги акантоза, появление участков ацетобелого эпителия с нежной мозаикой и пунктуацией. Диффузный хронический цервицит может сопровождать крапчатость при выполнении пробы Шиллера.
Клиницисту чрезвычайно важно помнить о том, что кольпоскопическая картина хронического цервицита может демонстрировать признаки, типичные для CIN. Именно поэтому нельзя ограничиться только лечением цервицита. Оно обязательно, но далее необходимо расширить границы диагностического поиска. Следует добавлять бактериоскопическое исследование мазка с окраской по Грамму, ПЦР с верификацией облигатных патогенов (не только хламидий, гонококков и трихомонад, исследование на ВПЧ ВКР).
Воспалительному процессу под силу замаскировать многие патологические изменения шейки матки. Вследствие воспалительного процесса может отмечаться гиподиагностика по результатам традиционных цитологических мазков, так как воспалительные элементы, элементы крови способны нарушать визуализацию и трактовку препарата.
Регенераторные изменения вследствие репарации участков десквамации эпителия при воспалениях могут способствовать цитологической гипердиагностике. Именно поэтому от эффективности лечения хронического воспаления в большой степени зависят точность диагностики других цервикальных заболеваний и их дальнейшая терапия. Недооценка этого факта сопряжена с высоким риском поздней диагностики рака, а переоценка — с чрезмерной хирургической активностью и с необоснованной травматизацией шейки, порой там, где ее можно и нужно было избежать. Клиницисту приходится балансировать между этими крайностями.
Как и в случае с цитологическим исследованием, диагностическая ценность кольпоскопии зависит от ее адекватности. Последнюю определяет состояние цервикального покрова, оценку которого могут затруднить выраженное воспаление эндо- и экзоцервикса с фибриноидными наложениями, обильные гнойные выделения, резкая гиперемия (иногда с десквамацией эпителия), деформации, аномалии строения шейки матки, кровотечения и смыкание стенок влагалища над шейкой матки (например, в III триместре беременности). На информативность кольпоскопии влияет видимость зоны трансформации: если стык эпителиев не виден, нет уверенности в визуализации всех очагов неоплазии. Именно поэтому в заключении к кольпоскопии клиницисту необходимо отразить информацию об адекватности исследования, типе зоны трансформации, видимости переходной зоны — зоны стыка эпителиев —и обозначить характеристики картин [16, 17].
Особую трудность представляет ведение женщин с плоскоклеточными интраэпителиальными поражениями шейки матки низкой степени (low grade squamous intraepithelial lesions, LSIL), которые включают в себя субклинические формы ПВИ, кондиломы и CIN I. Необходимость их деструктивного лечения дискутируется, так как без полного исследования всего аномального эпителия невозможно исключить поражение более тяжелой степени, не представленное в биоптате, при полиморфности повреждений — сосуществование неоплазий разной степени на одной шейке матки [14, 16, 18, 19]. Тактика в отношении LSIL окончательно не определена ввиду того, что после деструктивного лечения отмечается высокий процент рецидивов вследствие поверхностного воздействия на неоплазии эктоцервикса при неполном уничтожении более глубоких очагов CIN по ходу эндоцервикальных крипт [16, 18, 19].
Одновременно следует отметить, что легкие эпителиальные повреждения имеют высокую вероятность спонтанной элиминации — до 90%, а CIN I регрессирует в 60% случаев. В связи с этим для молодых женщин с LSIL, в том числе с CIN I, принята консервативная тактика введения в течение 18–24 месяцев. Представляется оправданным применение при LSIL средств, способствующих регрессу поражений [9, 10, 20–25]. К сожалению, специфические лекарственные средства, гарантированно и полностью элиминирующие ВПЧ и способствующие регрессии дисплазии, на сегодняшний день не созданы. При изучении состояния иммунной системы у женщин, страдающих ПВИ, многими авторами выявлены нарушения различных ее звеньев, а также высокая вероятность сопутствующего хронического воспалительного процесса. Это свидетельствует о целесообразности поиска противовирусных, иммуномодулирующих и противовоспалительных средств, способствующих коррекции иммунной системы и регрессу ПВИ.
Так, в литературе широко представлен опыт применения при ПВИ цидофовира, имиквимода, индол-3-карбинола, а также иммуномодуляторов для местного и системного применения [9, 15, 24, 26]. Среди них интерес представляют недавно созданные средства: гель вагинальный ДефлаГин, дииндолилметан, топические иммуномодуляторы типа Суперлимф и иммуномодуляторы системного действия. Следует отметить, что, несмотря на патогенетическую оправданность и продемонстрированную в исследованиях типа «случай — контроль» эффективность использования некоторых противовирусных и иммуномодулирующих препаратов, данные с высоким уровнем доказательности пока не представлены.
Важно следовать стандартной тактике и понимать, что при HSIL — CIN II–III/CIS применение противовирусных и иммуномодулирующих средств возможно лишь в дополнение к эксцизионному вмешательству (петлевой эксцизии зоны трансформации или конизации) в комбинированном лечении, но не в качестве монотерапии.
Комбинацию с хирургическим методом лечения следует применить также у больных с CIN I по истечении 18–24 месяцев неэффективного консервативного ведения и у пациенток старше 35 лет.
В качестве дополнения к хирургическому лечению у женщин с CIN можно использовать препарат с наибольшей доказательной базой инозин пранобекс, обладающий противовирусным и иммуномодулирующим свойствами [22]. На территории РФ зарегистрированы два бренда. Гроприносин под торговым наименованием является из двух дженериков эталонным референтным препаратом, согласно Реестру лекарственных средств. Референтный препарат — термин, введенный в 2015 году в качестве замены «оригинальному лекарственному препарату» или «препарату сравнения».
Иммуномодулирующее действие инозина пранобекса обусловлено увеличением продукции интерлейкинов, усилением пролиферации Тхелперов, стимуляцией хемотаксической и фагоцитарной активности моноцитов, макрофагов и полиморфноядерных клеток, а также подавлением репликации ДНК- и РНК-вирусов посредством связывания с рибосомами клетки и изменения их стереохимического строения. В исследовании Y. You и соавт. продемонстрировано, что инозин пранобекс позволяет уменьшить/прекратить вирусовыделение в очаге инфекции, улучшить заживление и увеличить безрецидивный промежуток [22].
Одна из таких работ проведена на базе Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова (Москва) [18]. Гроприносин был испытан в комплексной терапии 72 женщин, инфицированных ВПЧ ВКП, с гистологически подтвержденным поражением типа LSIL. Пациенток распределили на две равные группы: представительницам первой проводили хирургическое лечение и назначали указанный препарат, во второй ограничивались только оперативным вмешательством.
В качестве хирургического метода применена лазерная деструкция (выполняли на 5–9й день менструального цикла при условии полной кольпоскопической визуализации зоны трансформации). Инозин пранобекс назначали за 10–14 дней до деструкции в дозе 1000 мг 2 раза в сутки на протяжении 10 дней. Курс повторяли еще в течение 10–14 дней после операции.
Согласно результатам исследования, у получавших комбинированное лечение эпителизация шейки матки протекала быстрее, через 6 месяцев зарегистрировано отсутствие ВПЧ в очаге поражения (по данным ПЦРконтроля). Клиническое излечение (по результатам цитологического и кольпоскопического исследований) отметили у 92% пациенток после комбинированного и у 78% после хирургического лечения.
Еще в одном российском наблюдении 2016 года (n = 62) оценили эффективность комплексного подхода с использованием деструктивных методов лечения и инозина пранобекса у больных CIN I, что любопытно, с учетом соблюдения или несоблюдения врачебных рекомендаций относительно приема иммуномодулятора [21]. Всем участницам выполнили аргоноплазменную коагуляцию шейки матки, а также назначили 10дневные курсы инозина пранобекса за 2 недели до абляции и через 2 недели после нее.
«Норма» по результатам цитологического и кольпоскопического исследований через 3 и 6 месяцев выявлена у 97,5% и 86,4% принимавших инозин пранобекс согласно предписанным рекомендациям и отступивших от них. Выделение вируса из очага поражения в первые 2 месяца после лечения прекратилось у 92,5% и 63,6% пролеченных. Частота рецидивов атипических изменений за исследуемый период (6 месяцев) — 2,5% и 13,6%.
Таким образом, инозин пранобекс можно применять в составе комбинированного лечения (как дополнение к хирургическому вмешательству) для улучшения его результатов, уменьшения вероятности неизлеченности и рецидивов. Российские клинические рекомендации 2022 года такое назначение считают допустимым.
Инозин пранобекс при герпес-вирусной инфекции, согласно недавнему крупному исследованию в Китае, был так же эффективен, как и ацикловир, но более значительно снижал частоту рецидивов генитального герпеса [22].
Опубликованы еще несколько исследований опыта применения инозина пранобекса. Метаанализ результатов клинических исследований, посвященных лечению ВПЧ, позволяет констатировать целесообразность применения инозина пранобекса в данной группе пациенток, хотя многие из анализируемых клинических испытаний не отвечают требованиям доказательной медицины, так как не являются двойными слепыми плацебо-контролируемыми.
Лечить или выжидать?
В упоминаемом выше российском документе 2022 года [16] также нашла отражение лечебная тактика при доброкачественных и предраковых состояниях шейки матки. При истинной эрозии необходима патогенетическая терапия, то есть устранение причины, вызвавшей десквамацию эпителия (воспаления, травмы, возрастных атрофических процессов слизистой оболочки). Неосложненный эктропион шейки матки, эктопия цилиндрического эпителия лечения не требуют. Необоснованная деструкция, которой «грешат» российские клиницисты, в случае неоплазии не предупредит развитие неопластического процесса в скрытой части канала и может затруднить диагностику [16]. При лейкоплакии шейки матки вначале необходимо устранить сопутствующий воспалительный процесс, после чего исключить CIN.
В документе подчеркивают, что лейкоплакию отличает упорное, рефрактерное к терапии течение, в связи с чем при этом типе поражения оптимально избрать наблюдательную тактику, но предварительно провести гистологическое исследование для исключения CIN.
У молодых женщин с LSIL (с признаками ВПЧ-инфекции, койлоцитозом, CIN I), а также с CIN II при условии негативного результата теста на онкобелок р16 и удовлетворительного результата кольпоскопии с визуализацией всей зоны трансформации возможна наблюдательная тактика с повторением цитологического исследования через 6, 12, 24 месяца.
При сохранении CIN I более 2 лет от выжидательной тактики переходят к хирургическому лечению, в основном посредством эксцизии; деструкция возможна, только если видна вся зона трансформации с переходной зоной, возраст женщины менее 35 лет, аномалии в мазках из эндоцервикса отсутствуют и риск поражения эндоцервикальных крипт минимален.
При персистенции CIN II предпочтительна эксцизия, даже если пациентка очень молода. При HSIL (CIN II и положительном тесте на онкобелок р16, а также при CIN III) независимо от возраста пациентки лечение начинают без промедлений: методом выбора служит петлевая эксцизия.
В целом, к хирургическим методам лечения предрака относят: – абляцию — разрушение пораженного участка эпителия шейки матки путем электро-, радио-, лазерной и криодеструкции; – эксцизию — иссечение аномальной ткани тонкими проволочными петлями различных размеров и форм с захватом части цервикального канала разной глубины.
К абляции прибегают строго при соблюдении следующих условий: – отсутствуют подозрения на CIN II, CIN III, CIS, инвазивный рак; – зона трансформации видна полностью; – нет признаков поражения эктоцервикальных желез; – отсутствуют данные о вовлеченности эндоцервикса в патологический процесс; -ранее не проводили хирургическое лечение шейки матки; -нет расхождений между результатами цитологического, гистологического и кольпоскопического исследований.
- В остальных случаях методом выбора хирургического лечения должна быть эксцизия шейки матки. Патогенетически оправданным дополнением к хирургическому лечению документ называет использование иммуномодуляторов, например, инозина пранобекса, интерферонов и некоторых других средств. Врачу всегда следует помнить, что вероятность самоэлиминации ВПЧ у большинства инфицированных женщин способствует регресcии LSIL. Иммуномодуляторы не элиминируют ВПЧ полностью и не заменяют стандартную тактику.
Заключение
Предраковые цервикальные интраэпителиальные поражения шейки матки инициированы и ассоциированы с персистенцией ВПЧ высокого канцерогенного риска, и ВПЧ-тест является важным инструментом скрининга и ранней диагностики неопластического процесса. Сопутствующее хроническое и острое воспаление становится ко-фактором персистенции ВПЧ и затрудняет цитологическую и кольпоскопическую диагностику CIN. Информативность кольпоскопии зависит от видимости переходной зоны: отсутствие видимости зоны стыка эпителиев уменьшает точность диагностики степени CIN в биоптатах эктоцервикса.
В связи с высокой вероятностью регрессии LSIL у молодых женщин с первым типом зоны трансформации возможно наблюдение в течение 18–24 месяцев. При консервативном введении пациенток с LSIL и при комбинированном лечении женщин с CIN в дополнение к хирургическим методам возможно использование противовирусных и иммуномодулирующих средств для уменьшения рисков сохранения вирусной нагрузки, неизлеченности и рецидивов
Литература
1. Каприн А.Д., Старинский В.В., Петрова Г.В., ред. Злокачественные новообразования в России в 2022 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена; 2022. 250 с. 2. Rogovskaya S.I., Shabalova I.P., Mikheeva I.V., Minkina G.N., Podzolkova N.M., Shipulina O.Y. et al. Human papillomavirus prevalence and type-distribution, cervical cancer screening practices and current status of vaccination implementation in Russian Federation, the Western countries of the former Soviet Union, Caucasus Region and Central Asia. Vaccine. 2013; 31(suppl.7): H46–58. DOI: 10.1016/j.vaccine.2013.06.043 3. Bourmenskaya, Shubina E., Trofimov D., Rebrikov D., Sabdulaeva E., Nepsha O. et al. Host gene expression profiling of cervical smear is eligible for cancer risk evaluation. J. Clin. Pathol. 2013; 66(4): 282–5. DOI: 10.1136/jclinpath-2012-201313 4. Туранова О.В., Белокриницкая Т.Е. Особенности ВПЧ-инфекции у женщин репродуктивного возраста и эффективные методы диагностики ВПЧ-ассоциированной патологии шейки матки. Фарматека. 2019; 26(6): 53– 5. Доброхотова Ю.Э., Венедиктова М.Г., Гришин И.И., Саранцев А.Н., Морозова К.В., Луценко Н.Н. Комплексное лечение дисплазии эпителия шейки матки умеренной и тяжелой степени на фоне ВПЧ-инфекции. Гинекология. 2015; 17(1): 8– 6. Шипулина О.Ю., Гончаревская З.Л., Романюк Т.Н., Лешкина Г.В., Роговская С.И., Шипулин Г.А. Использование ВПЧ-теста в скрининге онкологической патологии шейки матки, результаты пилотного исследования. В кн.: Покровский В.И., ред. Молекулярная диагностика. Сборник трудов. М.: 2014: 229–32. 7. Almeida A.M., Queiroz J.A., Sousa F., Sousa Â. Cervical cancer and HPV infection: ongoing therapeutic research to counteract the action of E6 and E7 oncoproteins. Drug Discov. Today. 2019; 24(10): 2044–57. DOI: 10.1016/j.drudis.2019.07.011 8. Zur Hausen H. Papillomaviruses and cancer: from basic studies to clinical application. Rev. Cancer. 2002; 2(5): 342–50. DOI: 10.1038/nrc798 9. Hoffman S.R., Le T., Lockhart A., Sanusi A., Dal Santo L., Davis M. et al. Patterns of persistent HPV infection after treatment for cervical intraepithelial neoplasia (CIN): a systematic review. J. Cancer. 2017; 141(1): 8–23. DOI: 10.1002/ijc.30623 10. Comprehensive cervical cancer control. A guide to essential practice, 2nd Geneva, Switzerland: World Health Organization; 2014. 405 p. 11. Castle P.E., Burk R.D., Massad L.S., Eltoum I.E., Hall C.B., Hessol N.A. et al, Epidemiological evidence that common HPV types may be common because of their ability to evade immune surveillance: Results from the Women’s Interagency HIV study. J. Cancer. 2022. DOI: 10.1002/ijc.32693. 12. Jeronimo J., Castle P.E., Temin S., Denny L., Gupta V., Kim J.J. et al. Secondary prevention of cervical cancer: ASCO Resource-Stratified Clinical Practice Guideline. URL: https://www.asco.org/practice-guidelines/quality-guidelines/guidelines/gynecologic-cancer#/14021 (дата обращения – 15.10.2019). 13. US Preventive Services. Task Force. Draft Recommendation Statement. Cervical cancer: screening. URL: https://www.uspreventiveservicestaskforce.org/Page/Document/draft-recommendation-statement/cervical-cancer-screening2 (дата обращения – 15.10.2019). 14. Moscicki A.B., Flowers L., Huchko M.J., Long M.E., MacLaughlin K.L., Murphy J. et al. Guidelines for cervical cancer screening in immunosuppressed women without HIV infection. Low Genit. Tract Dis. 2019; 23(2): 87–101. DOI: 10.1097/LGT.0000000000000468 15. Castle P.E., Giuliano A.R. Chapter 4: Genital tract infections, cervical inflammation, and antioxidant nutrients — assessing their roles as human papillomavirus cofactors. J. Natl. Cancer Inst. Monogr. 2003; 31: 29–34. DOI: 10.1093/oxfordjournals.jncimonographs.a003478 16. Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака. Клинические рекомендации 2022 г. Письмо Министерства здравоохранения РФ от 2 ноября 2022 г. №15-4/10/2-7676. UR: https://spnavigator.ru/document/0a7d702f-61a2-40b9-b9f6-8c1fa71273b0 (дата обращения – 15.10.2019). 17. Роговская С.И. Практическая кольпоскопия. М.: ГЭОТАР-Медиа; 2016. 256 с. 18. Короленкова Л.И. Цервикальные интраэпителиальные неоплазии и ранние формы рака шейки матки. Клинико-морфологическая концепция цервикальногого канцерогенеза. М. ООО «Ай-Пи»; 2022. 300 с. 19. Kahramanoglu I., Demirkiran F., Turan H., Bese T., Yilmaz N., Ilvan S. et al. The use of colposcopic punch biopsy in the management of abnormal cervical cytology: a 5-year retrospective audit. Obstet. Gynaecol. 2019; 39(1): 110–14. DOI: 10.1080/01443615.2018.1468740 20. Smith R.A., Andrews K.S., Brooks D., Fedewa S.A., Manassaram-Baptiste D., Saslow D. et al. Cancer screening in the United States, 2022: a review of current American Cancer Society guidelines and current issues cancer screening. CA Cancer Clin. 2017; 67(2): 100–121. DOI: 10.3322/caac.21392 21. Роговская С.И., Ипастова И.Д. Тяжело в прочтении, легко в бою. Обзор российских клинических рекомендаций 2017 года «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака». 2019; 19: 61–8. 22. You Y., Wang L., Li Y., Wang Q., Cao S., Tu Y. et al. Multicenter randomized study of inosine pranobex versus acyclovir in the treatment of recurrent herpes labialis and recurrent herpes genitalis in Chinese patients. J. Dermatol. 2015; 42(6): 596–601. DOI: 10.1111/1346-8138.12845 23. Bennett K.F., Waller J., Ryan M., Bailey J.V., Marlow L.A.V. The psychosexual impact of testing positive for high-risk cervical human papillomavirus (HPV): a systematic review. Psychooncology. 2019; 28(10): 1959–70. DOI: 10.1002/pon.5198 24. Ciavattini A., Serri M., Di Giuseppe J., Liverani C.A., Gardella B., Papiccio M. et al. Long-term observational approach in women with histological diagnosis of cervical low-grade squamous intraepithelial lesion: an Italian multicentric retrospective cohort study. BMJ Open. 2019; 9(7): e024920. DOI: 10.1136/bmjopen-2018-024920 25. Huber J., Pötsch B., Gantschacher M., Templ M. Routine treatment of cervical cytological cell changes: diagnostic standard, prevention and routine treatment of cervical cytological cell changes – an assessment of primary and secondary prevention and routine treatment data in the context of an anonymous data collection from practicing gynaecologists; an academic, non-interventional study. Geburtshilfe Frauenheilk. 2016; 76(10): 1086–91. DOI: 10.1055/s-0042-105286 26. Tai Y.J., Chen Y.Y., Hsu H.C., Chiang C.J., You S.L., Chen H.C. et al. Clinical management and risk reduction in women with low-grade squamous intraepithelial lesion cytology: a population-based cohort study. PLoS One. 2017; 12(12): e0188203. DOI: 10.1371/journal.pone.0188203
Злокачественные новообразования кожи
Клетки тканей подобных опухолей сложно дифференцировать на начальном этапе развития. Они утратили способность выполнять собственные функции, могут проникать в близкорасположенные ткани и органы, часто дают метастазы в кровеносные и лимфатические сосуды, формируя опухоли по всему организму.
Злокачественные кожные новообразования делят на несколько групп, в соответствии с их клеточным строением и клиническими проявлениями:
- Меланома — наиболее распространенная злокачественная опухоль. Локализуется в коже. В большинстве случаев меланома является следствием перерождения невуса на фоне сильного его ожога или травмы. Поэтому травма невуса является основным фактором риска озлокачествления новообразования. Особенно опасны образования на участках, которые постоянно подвергаются трению. Лечение показано хирургическое, иногда с использование лучевой и химиотерапии. Прогноз болезни находится в прямой зависимости от времени обнаружения опухоли и ее лечения;
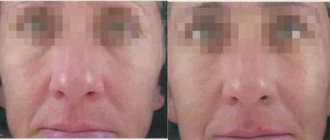
- Базалиома. Возникает на участках кожи, часто подвергаемых избыточному солнечному воздействию. Развитию заболевания способствует наследственность. В течение нескольких лет перерождается в плоскоклеточный рак кожи. На начальном этапе образование имеет вид беловатого узелка, на поверхности которого формируется сухая корочка;
- Плоскоклеточный рак или эпителиома наблюдается реже и имеет тяжелое течение. Очагом локализации чаще всего является перианальная область, наружные половые органы. Отличить его от другого вида рака практически визуально невозможно, быстро метастазирует. На начальном этапе опухоль имеет вид шара в толще кожи диаметром не более сантиметра. По мере роста формируются бородавки и изъязвления, после чего края становятся плотными и неровными, появляются сильные боли. Как только образование дает метастазы в лимфоузлы, состояние пациента быстро ухудшается. Летальный исход может наступить вследствие кровотечения на фоне распада опухоли и повреждения сосудов, а также в результате быстрого истощения организма. В целях лечения показано хирургическое удаление опухоли и лимфоузлов, нередко в сочетании с лучевой и химиотерапией;
- Саркома Капоши или ангиоретикулез. Заболевание в большинстве случаев развивается у больных СПИДом, однако обычная форма заболевания клинически имеет идентичное клиническое и гистологическое проявление. В группу риска входят мужчины. Очагом локализации заболевания являются нижние конечности. Сначала формируются фиолетовые, иногда лилового цвета пятна, не имеющие четких границ. Постепенно появляются плотные узелки округлой формы синюшно-бурого цвета, доходящие в диаметре до двух сантиметров. Эти узелки часто объединяются и изъязвляются. У больных СПИДом заболевание имеет агрессивное течение, нередко с резким поражением лимфоузлов и дачей метастазов по всему организму.
Симптомы и признаки
Клиническая картина развития рака кожи зависит от его вида. Зачастую первые признаки опухоли принимаются за другие кожные заболевания. От этого происходит несвоевременное обращение к врачу и распространение злокачественного процесса. Общими признаками для всех типов рака кожи являются:
- Появление на коже пятна или уплотнения небольшого размера. Цвет образования может быть розоватым, серо-желтым. Примечательно отличие окраса новообразования от родинок и веснушек.
- Неровная форма и ассиметричные контуры патологического очага.
- Появление зуда, незначительного дискомфорта в области опухолевого процесса. Данный симптом появляется спустя некоторые время после образования рака.
- Прогрессирующий рост новообразования.
- Наличие усталости, слабость, резкий упадок сил.
- Снижение аппетита, вследствие чего происходит резкая потеря веса.
- По мере развития рака происходит поражение регионарных лимфоузлов.
При появлении любого из вышеперечисленных признаков рекомендуется обратиться за медицинской помощью. В зависимости от вида рака кожи выделяют следующие симптомы:
- Базалиома. Относится к самой распространенной форме опухоли кожных покровов. Характеризуется благоприятным прогнозом при выявлении на начальной стадии. Появляется в виде узелка, безболезненного при пальпации. Он имеет серовато-розовый цвет. Поверхность узелка, как правило, гладкая. Возможно образование чешуек. По мере распространения опухолевого процесса увеличивается пораженная зона. Новообразование покрывается кровянистой пленкой. Преимущественной локализацией базальноклеточного рака является лицо, шея, область рук. Существенного изменения состояния базалиома не вызывает. Это является причиной позднего обращения за медицинской помощью.
- Плоскоклеточный рак. На раннем этапе имеет вид плотного узелка красного или коричневого цвета. Опухоль данного вида склонна к быстрому распаду, в связи с чем, по мере прогрессирования процесса, образуется язва. Она часто кровоточит, ее края неоднородны. Плоскоклеточный рак быстро прорастает в близлежащие ткани. При выявлении на поздней стадии возможно метастазирование в регионарные лимфатические узлы или органы.
- Меланома. Относится к агрессивному типу опухоли. Наиболее часто меланома возникает на месте травмированного невуса, который увеличивается в размере, меняет окрас и приобретает неровные контуры. Характерной особенностью данного вида рака являются ассиметричная форма образования, а также склонность к кровоточивости. Злокачественное новообразование зудит, увеличивается в размере. По мере развития процесса опухоль превращается в язву. Меланома быстро прогрессирует и часто дает метастазы.
- Аденокарцинома. На начальной стадии развития выглядит как плотный узелок. Локализуется чаще всего в области подмышечной впадины, под грудью. С развитием опухолевого процесса происходит прорастание аденокарциномы в близлежащие ткани. Опухоль данного вида выявляется крайне редко и характеризуется медленным ростом.
Симптомы рака кожи
Симптомы базальноклеточного рака крайне вариабельны и зависят от формы заболевания. Опухоль манифестирует со следующих проявлений:
- Блестящие узелки розового цвета с проступающими сосудиками.
- Папулы или узелки, покрытые язвочками.
- Бляшки. Плотные, похожие на рубцы.
- Псориазоподобные бляшки.
Стадии базальноклеточной опухоли кожи:
- 1 стадия — опухоль имеет не более 2 см в наибольшем измерении.
- 2 стадия — размеры опухоли превышают 2 см, но нет прорастания (инвазии) в подлежащие ткани.
- 3 стадия — рак кожи прорастает в подлежащие структуры, например, мышцы или кости. Или менее инвазивная опухоль, но имеющая регионарные метастазы.
- 4 стадия — опухоль дает отдаленные метастазы.
Диагностика
Диагностика злокачественных новообразований кожи в большинстве случаев несложная. Обследование больного должно начинается со сбора анамнеза и врачебного осмотра, при этом особое внимание уделяется полному обследованию кожных покровов и регионарных лимфатических узлов.
К основным диагностическим мероприятиям для подтверждения рака кожи можно отнести:
- Дерматоскопию — визуальную оценку опухоли, приближенной при помощи специальных увеличительных стекол;
- Термографию — измерение температуры новообразования;
- Мазок — отпечаток. Метод, при котором предметное стеклышко прикладывают к освобожденной от корок язве с несильным надавливанием. Используются несколько стеклышек и разные участки предполагаемой опухоли. После собранные отпечатки исследуют при помощи микроскопии;
- Соскоб. При помощи специального деревянного шпателя соскребают некоторое количество содержимого со дна изъязвленной поверхности и переносят материал на предметное стекло с последующим его изучением;
- Биопсию. При пункционном виде, при помощи иглы со шприцом, берут клеточный материал с глубины образования. При эксцизионном варианте, который возможен при мизерных размерах образования, производят его иссечение в пределах не подверженных процессу тканей, с последующим исследованием удаленного участка. При инцизионном варианте клиновидно удаляют большое новообразование, захватывая здоровые тканевые структуры;
- Визуализирующие методы, необходимые для уточнения и проверки распространения онкопроцесса. К ним относят: ультразвуковой скрининг, обследование компьютерным томографом.
Лечение в Юсуповской больнице
В Юсуповской больнице предоставляются в круглосуточном режиме услуги диагностики и лечения всех доброкачественных новообразований кожи. Специалисты высочайшего уровня помогут за короткое время устранить как косметический дефект, так и предотвратить последствия неправильной тактики лечения. Чаще всего в качестве лечения новообразований на коже применяется хирургическая методика, при которой происходит полное удаление пораженных тканей с небольшим захватом здоровых. Выбор хирургических манипуляций достаточно широкий, их применение зависит от стадии и вида опухоли:
- Криотерапия — удаление неоплазии при помощи жидкого азота. Эффективный и безопасный метод, применяется в начальных фазах.
- Электроэксцизия — иссечение новообразования при помощи электроножа;
- Лазерная деструкция — удаление патологии при помощи специального лазера, без влияния на окружающие, неповрежденные ткани;
- Иссечение — метод, при котором скальпелем иссекают неоплазию в необходимом для данного случая объеме, возможно, включая здоровые ткани и даже подкожную клетчатку, а также фасцию с регионарными лимфоузлами. Радикальный метод может помочь при поздних стадиях заболевания.
Прогноз может быть самым разнообразным, все зависит от вида и стадии заболевания. При отсутствии метастазов и адекватном лечении, шансы на благоприятный исход достигают 80-90%. Чем сильнее распространен онкопроцесс, тем ниже шансы на хороший исход.
В Юсуповской больнице диагностика и лечение пациентов проходят в условиях максимально продуктивных и наиболее комфортных. Специалисты работают на современной технике, следят за новшествами в медицинских отраслях, ведут собственные исследования и динамические наблюдения. Палаты обустроены для максимального комфорта, уделено внимание и досугу пациентов. Весь персонал приветлив, отзывчив и компетентен.