Герпесвирусы 6, 7, 8-го типов
За последние 15 лет выделены три новых антропонозных представителя этого семейства — HHV-6, HHV-7, HHV-8, которые характеризуются многообразием клинических проявлений и бессимптомным носительством.
HHV-6
Герпесвирус 6-го типа (HHV-6, ВГЧ-6) относительно недавно внесен в список известных человеческих патогенов и является серьезным претендентом на роль этиологического агента рассеянного склероза и лихорадки новорожденных с судорожным синдромом, инфекционных мононуклеозов негативных по вирусу Эпстайна–Барр (ВЭБ) и цитомегаловирусу (ЦМВ) и ассоциированного с HHV-6 энцефалита. HHV-6 также является кофактором СПИДа, некоторых форм карцином шейки матки и назофарингеальных карцином.
Впервые HHV-6 был выделен в 1986 г. из лимфоцитов периферической крови пациентов с различными лимфопролиферативными заболеваниями, в том числе инфицированных ВИЧ. Новый вирус был назван В-лимфотропным вирусом человека (HBLV — human B-lymphotropic virus). HBLV инфицировал только свежие В-лимфоциты in vitro. Позднее был описан более широкий спектр клеточного тропизма, преимущественно к Т-клеткам, вследствие чего вирус переименовали в HHV-6.
HHV-6 сходен с остальными герпесвирусами, но отличается от них по биологическим, иммунологическим свойствам, спектру чувствительных клеток, антигенной структуре, составу генома, количеству и молекулярной массе структурных вирусных белков. Диаметр вириона — 160–200 нм, тип симметрии икосаэдрический, содержит 162 капсомера, имеет суперкапсидную липидосодержащую оболочку. Геном представлен двунитчатой ДНК. Рестрикционный анализ ДНК HHV-6 установил вариабельность генома различных изолятов вируса. При сравнении первичной структуры геномов HHV-6 и ЦМВ было обнаружено их определенное сходство. Степень гомологии между HHV-6 и ЦМВ была большей, чем между HHV-6 и другими герпесвирусами, что свидетельствует о тесной связи геномов этих двух вирусов.
Исследования изолятов HHV-6 от людей с различной патологией показали, что они принадлежат к двум вариантам: А или В (HHV-6А и HHV-6В). Варианты различаются между собой по клеточному тропизму in vitro, рестрикционному эндонуклеазному профилю, нуклеотидной последовательности, реактивности с моноклональными антителами, сероэпидемиологии и причастности к различным заболеваниям. Инфекция, индуцированная HHV-6А, наблюдается реже, и роль данного варианта вируса в патологии человека недостаточно ясна, а HHV-6В является основным этиопатогеном внезапной экзантемы (Exantema subitum).
Репликация in vitro. Вирус HHV-6 селективно тропен к CD4+-Т-клеткам, но также способен поражать Т-клетки с детерминантами CD3+, CD5+, CD7+, CD8–. Вирус реплицируется во многих клеточных первичных и перевиваемых культурах различного происхождения: лимфоцитах Т-ряда, моноцитарно-макрофагальных, мегакариоцитах, глиальных клетках, клетках тимуса, в свежевыделенных лимфоцитах человека. Ростовой цикл вируса длится 4–5 дней. Оболочечный вирион идентифицировали методом электронной микроскопии на 5-й день после инфицирования в цитоплазме клеток и экстрацеллюлярно; вирусную ДНК и нуклеокапсид — на 3-й день. Инфицированные HHV-6 клетки на 5-й день образовывали синцитии с ядерными и цитоплазматическими включениями, о крупные клетки, репродукция вируса сопровождалась деструкцией и лизисом клеток. На 5–10-й день почти 90% всех клеток были поражены вирусом.
Эпидемиология HHV-6-инфекции. Первые клинико-эпидемиологические исследования, проведенные в 1986 г., выявили наличие этой инфекции в зоне отдыха в штате Невада (США). Клинически заболевание выражалось в гриппоподобной симптоматике с повышением температуры, ночным потом, увеличением лимфатических узлов, рядом психологических симптомов (усталость, депрессия). Заболевание получило название «синдром хронической усталости». При этом у 75% больных выявлялись антитела к HHV-6. Год спустя первый больной с клинически сходным заболеванием и антителами к HHV-6 в крови был зарегистрирован в Германии. В дальнейшем эта инфекция была выявлена в Европе (Англия, Швеция) и Африке. При этом разные исследователи сообщили о выделении HHV-6 из клеток крови не только от лиц с различными лимфопролиферативными и гематологическими заболеваниями, инфицированных HTLV-1, ВИЧ-1 и ВИЧ-2 или больных СПИДом, но и от здоровых взрослых.
По данным российских авторов, у 80% здоровых доноров, у 65% ВИЧ-инфицированных и 73% онкологических больных выявляются антитела к HHV-6. При рождении большинство детей серопозитивны за счет материнских антител, титр которых снижается к 5 мес. Однако к одному году процент серопозитивных малышей оказывается таким же, как среди старших детей и взрослых. Высокая частота выявления антител и ранний возраст инфицирования указывают на присутствие вируса в ближайшем окружении. Выделение HHV-6, определение вирусных белков и ДНК в образцах слюны и мокроты указывают на то, что вирус находится в организме человека в слюнных железах, а эксперименты in vitro показали, что он в латентной фазе сохраняется в моноцитах/макрофагах. В естественных условиях основным путем передачи вируса является воздушно-капельный. Нельзя исключить вертикальный путь заражения; антигены вируса присутствовали в абортивном материале в ряде случаев при спонтанных абортах. Также не исключаются половой путь передачи вируса и перинатальная инфекция. Длительная репродукция при острой инфекции и персистенция HHV-6 в клетках крови внешне здоровых людей, включая доноров, является серьезным фактором риска передачи вируса при переливании крови и ее компонентов, трансплантации органов и тканей. Посттрансплантационная серологическая конверсия к HHV-6 отмечается у 43% реципиентов. При этом повышенный титр антител к HHV-6 в крови реципиентов персистировал в течение 2 лет после трансплантации.
Диагностика. Диагностика HHV-6-инфекции основана на сравнительном анализе результатов выделения вируса на чувствительных культурах клеток от больного, обнаружении вирусных белков (при использовании иммунопероксидазного и иммунофлюоресцентного методов, электронной микроскопии) или его генома (при использовании методов гибридизации и полимеразной цепной реакции (ПЦР)) в материалах от больного и выявлении вирусспецифических антител в крови. Вирусспецифические иммуноглобулины класса М (IgM) синтезируются через 2 нед после острой первичной инфекции, достигая титра 1:1280, по данным непрямой иммунофлюоресценции, а класса G (IgG) — на неделю позже и достигают более высокого титра — 1:10240. Поскольку титр IgM быстро снижается и они исчезают через 4–6 нед, острая первичная HHV-6-инфекция диагностируется по наличию IgG (положительным считается титр выше 1:20). Синтез IgM возможен как при первичной, так и при реактивации латентной HHV-6-инфекции. Периодическая реактивация и активная персистентная HHV-6-инфекция у больных с дефектом иммунного ответа, как и при других герпесвирусных инфекциях, приводит к повышению титра вирусспецифических IgG, зачастую без соответствующего повышения титра IgМ.
Первичная HHV-6-инфекция у иммунокомпетентных лиц диагностируется на основании корреляции наличия и нарастания титров вирусспецифических IgG и IgМ с динамикой развития клинических проявлений заболевания. Серологическое исследование должно дополняться выделением вируса и/или обнаружением генома. При иммунных нарушениях и реактивации HHV-6-инфекции число таких геномнесущих клеток возрастает до 50–70, а обнаружение геномнесущих клеток в пределах 200-7500 свидетельствует о патогенетической связи реактивированной HHV-6-инфекции с заболеванием.
Клиника. Спектр заболеваний, связанных с HHV-6, довольно широк. Полиморфизм патологии зависит как от формы инфекции, так и от штаммовых различий вируса.
К заболеваниям, ассоциированным с первичной острой HHV-6-инфекцией, относятся: синдром хронической усталости (миалгический энцефаломиелит); внезапная экзантема у новорожденных и более старших детей (roseola infantum exantema subitum); инфекционный мононуклеоз у подростков и взрослых, не связанный с ВЭБ-инфекцией; гистиоцитарный некротический лимфаденит (KiKuchi’s lymphadenitis).
Заболевания, ассоциированные с персистентной HHV-6-инфекцией, включают: лимфопролиферативные (иммунодефицит, лимфаденопатия, поликлональная лимфопролиферация); злокачественные лимфомы (неходжкинская лимфома, периферическая Т-клеточная лейкемия, В-клеточная лимфома, дерматопатическая лимфаденопатия, болезнь Ходжкина, синусоидальная В-клеточная лимфома, плеоморфная Т-клеточная лимфома).
HHV-6 связывают с различными лимфопролиферативными и иммуносупрессивными заболеваниями, с внезапной экзантемой новорожденных, злокачественными новообразованиями, аутоиммунной патологией, некоторыми заболеваниями ЦНС и др. Реинфекция HHV-6 наблюдается у больных с нарушенным иммунным статусом, иммуносупрессией (трансплантация органов, СПИД и др.).
Доказана этиологическая роль HHV-6 в развитии внезапной экзантемы — широко распространенного заболевания детей в возрасте от 3 мес до 3 лет. В части случаев причиной молниеносной экзантемы является HHV-7. Инкубационный период заболевания — 5–15 дней. Заболевание характеризуется высокой лихорадкой (38,5–40°С) в течение 3–5 дней, в дальнейшем в течение 1–3 дней наблюдаются эритематозная или макулезная кожная сыпь, которая совпадает со снижением температуры. Около половины всех случаев первой в жизни лихорадки новорожденных связаны с первичным инфицированием HHV-6.
С развитием экзантемы связывают преимущественно вариант HHV-6В. В период лихорадки (и даже перед этим) вирус присутствует в CD4+-клетках; в это время выделить вирус из крови больных удается более чем в 90% случаев.
Антитела к HHV-6 отсутствуют в острой фазе болезни и начинают определяться в большинстве случаев на 6–8-й день от начала заболевания. IgM-антитела выделяются на 5-й день лихорадки и обнаруживаются в течение 2–3 нед. IgG-антитела появляются на 7-й день, достигая максимума через 2–3 нед, и персистируют длительное время. Обычно заболевание заканчивается без осложнений, но описаны клинические случаи манифестной инфекции с различными симптомами: лихорадка выше 40°С, воспаление барабанной перепонки, респираторные и гастроинтестинальные симптомы, неврологические осложнения (энцефалиты, менингоэнцефалиты, асептический менингит, судороги с последующей эпилепсией); имеются сообщения о протекании первичной HHV-6-инфекции с гепатоспленомегалией, фатальным фульминантным гепатитом, фатальной диссеминированной инфекцией.
Потенциальная онкогенность HHV-6 и роль в характеризующемся множеством стадий процессе онкогенеза подтверждается следующими фактами. HHV-6 активирует онкопротеины Е6 и Е7 вируса папилломы человека при цервикальной карциноме. ДНК HHV-6 способна индуцировать неопластическую трансформацию клеток NIH3T3 in vitro и на животных моделях.
При анализе образцов слюны от больных назофарингеальной карциномой, методом ПЦР в ряде случаев выявлена ДНК HHV-6. У этих же больных было отмечено достоверное повышение титров антител к HHV-6 класса IgG и, в отличие от здоровой популяции, найдены антитела класса IgA. Таким образом, можно полагать, что наличие антител класса IgA к HHV-6 может служить признаком назофарингеальной карциномы.
Методом ПЦР, гибридизации in situ, ДНК HHV-6 была идентифицирована в тканях и клетках биопсийных образцов ходжкинских, смешанных В- и Т-клеточных неходжкинских лимфом, при ангиоиммунобластоидной лимфаденопатии, африканской лимфоме Беркитта, Т-клеточной острой лимфобластоидной лейкемии, лимфогранулематозе, инфекционном мононуклеозе, не связанном с ВЭБ, и ряде других лимфопролиферативных заболеваний.
Роль HHV-6 в возникновении синдрома хронической усталости обсуждается различными авторами, однако доказательства, которые приводятся в подтверждение этой гипотезы, неоднозначны.
HHV-7
HHV-7 впервые изолирован из CD+-Т-клеток здоровых людей. Анализ гибридизации ДНК показал, что HHV-7 отличается от уже известных герпесвирусов, но имеет идентичные участки с ЦМВ и HHV-6.
История открытия этого вируса такова: в 1990 г. в процессе изучения ВИЧ-1 в Военно-медицинском научно-исследовательском институте США было отмечено, что в 13-дневных культурах неинфицированных активированных CD4+-Т-клеток, полученных от внешне здорового 26-летнего обследуемого, развивается спонтанный цитопатический эффект, характеризующийся «баллонизацией» клеток и небольшим синцитием. При этом клетки были свободны от ВИЧ-инфекции, что подтверждалось отсутствием р24 ВИЧ и обратнотранскриптазной активности. Эти культуры клеток были переданы в Национальный институт аллергии и инфекционных болезней (США), где в ходе дальнейших исследований вышеуказанный изолят был обозначен как HHV-7 — ВГЧ-7.
Позднее вирус с аналогичными характеристиками был выделен другими исследователями.
Сероэпидемиологические исследования показали, что HHV-7 широко распространен. Частота изоляции HHV-7 у детей в возрасте 0–11 мес составляет 0%, 12–23 мес — 50%, 24–35 мес — 75%, старше 36 мес — 100% (в отличие от HHV-6 , при котором сероконверсия отмечается в возрасте до 12 мес). В крови доноров ДНК HHV-7 была выявлена у 97,3% обследованных лиц, при этом носительство генома HHV-7 отмечалось на протяжении 53 нед. Таким образом, HHV-7 персистирует у хозяина уже после первичной инфекции и максимально часто изолируется от здоровых взрослых.
При электронно-микроскопическом исследовании ультратонких срезов клеток, инфицированных HHV-7, выявлены типичные для герпесвируса вирионы диаметром до 170 нм, ДНК 150Кб. Вирионы содержали электронно-плотное цилиндрическое ядро, капсид, тегумент и внешнюю оболочку и имели значительное морфологическое сходство с HHV-6. Гибридизационный анализ показал, что ДНК HHV-7 отличается от ДНК вируса простого герпеса, ВЭБ, опоясывающего лишая и ЦМВ. В то же время ДНК ЦМВ имеет ограниченную перекрестную гибридизацию с ДНК HHV-7 (гомология находится на уровне 36%). Несколько большее сходство выявлено между ДНК HHV и ДНК HHV-7 (по разным данным, гомология находится на уровне 57,5–58,8%). Однако на основании ряда критериев можно сделать вывод, что речь идет о разных вирусах, а не о различных штаммах одного вируса. К настоящему времени HHV-7 классифицируется как член подсемейства β-герпесвирусов.
Распространенность инфекции и пути ее передачи неизвестны. Имеются данные и о выделении HHV-7 из слюны инфицированных, а также персистенции вируса в Т-лимфоцитах, в связи с чем предполагается возможность наличия воздушно-капельного пути передачи инфекции, особенно у детей раннего возраста, и передачи инфекции при переливании крови и ее компонентов. Для выделения и идентификации HHV-7 используют культуру мононуклеаров периферической крови, метод непрямой иммунофлюоресценции, электронной микроскопии, молекулярной гибридизации и сиквенс-анализа ДНК.
Значение HHV-7 в патологии не изучено. HHV-7 ассоциируется с лимфопролиферативными заболеваниями, синдромами хронической усталости и иммунодефицита.
Как самостоятельное заболевание синдром хронической усталости впервые был выделен в 1988 г. Центром по контролю заболеваний (The Centers for Disease Control–CDC, Атланта, США). Поводом для этого послужило внезапное увеличение в штате Невада в 1984 г. числа больных, жалующихся на постоянную усталость, сопровождающуюся рядом соматических и психологических симптомов — при отсутстви видимой причины заболевания. Подобные вспышки заболевания наблюдались и раньше: в Лос-Анжелесе в 1934 г., в Исландии в 1948 г., в Лондоне в 1955 г., во Флориде в 1956 г. Работы по изучению синдрома хронической усталости в США возглавили P. Cheney и D. Peterson. Вскоре в США были открыты специальные клиники для этих больных и создана Национальная ассоциация. Данное заболевание в настоящее время изучается также в Великобритании, Германии, Австралии, Японии и других странах.
В опубликованном CDC в марте 1988 г. в журнале «Annals of Internal Medicine» докладе были сформулированы диагностические критерии (большие и малые) синдрома хронической усталости. Этот диагностический комплекс подвергался пересмотру в 1991, 1992, 1994 гг. К большим (обязательным) диагностическим критериям относят наблюдающиеся в течение не менее 6 мес у ранее здоровых людей постоянную усталость и снижение работоспособности на 50% и более. Вторым обязательным критерием является отсутствие заболеваний или других причин, которые могут вызвать такое состояние.
Малые критерии можно объединить в несколько групп. Первая из них включает симптомы, отражающие наличие хронического инфекционного процесса: субфебрильная температура, хронический фарингит, увеличение лимфатических узлов (шейных, затылочных, подмышечных), мышечные и суставные боли. Вторая группа — психические и психологические проблемы: нарушение сна (гипо- или гиперсомния), снижение памяти, повышенная раздражительность, снижение интеллекта, невозможность концентрации внимания, депрессия и т. д.). Третью группу составили симптомы вегетативно-эндокринной дисфункции: быстрое изменение массы тела, нарушение функции желудочно-кишечного тракта, снижение аппетита, аритмия, дизурия, быстрая физическая утомляемость с последующей продолжительной (более 24 ч) усталостью и др. Четвертая группа объединяет симптомы аллергии и повышенной чувствительности к лекарственным препаратам, инсоляции, алкоголю и некоторым другим факторам.
Согласно диагностическим критериям 1994 г., диагноз синдрома хронической усталости считается достоверным, если у больного выявлены два обязательных критерия и четыре признака из приведенных ниже восьми дополнительных (которые также наблюдаются не менее 6 мес): нарушение памяти или концентрации внимания; фарингит; болезненные шейные лимфатические узлы; мышечные боли; полиартралгии; необычная, новая для больного головная боль; неосвежающий сон; недомогание после физического напряжения.
Распространенность синдрома хронической усталости, по данным большинства исследователей, в разных странах и социально-демографических группах приблизительно одинакова. Заболеванию подвержены люди любого возраста, однако замечено, что женщины в возрасте 25–49 лет болеют чаще, чем мужчины.
Предполагается, что HHV-7 может быть причиной exanthema subitum, но не прямо, а опосредованно, за счет реактивации HHV-6 из латентного состояния. HHV-7 селективно тропен к CD+-Т-клеткам. Показано что вирус инфицирует CD4+ в 42%, а CD8+ в 4% случаев. При взаимодействии HHV-7 и HIV ВИЧ появляется конкурирующий эффект за очередность инфицирования CD+-лимфоцитов.
HHV-8
HHV-8 — это герпесвирус, ассоциированный с саркомой Капоши (KS). Был недавно открыт и идентифицирован молекулярным клонированием с использованием тканей саркомы Капоши. KS — многоочаговая злокачественная опухоль сосудистого происхождения с преимущественным поражением кожных покровов и вовлечением внутренных огранов и лимфатических узлов. Выделяют четыре различные эпидемиологические формы KS: классическая, африканская, ятрогенная и СПИД-ассоциированная KS. HHV-8 подразделяют на три варианта: А, В и С — на основании различий в нуклеотидных последовательностях субсегментов генома.
Вариант А связывают с классической KS и со СПИД-ассоциированными поражениями кожи и внутренних органов, а В и С — с лимфопролиферативными заболеваниями (лимфомами, генерализованными лимфаденопатиями, болезнью Кастлемана).
Вирусная теория развития KS первые была выдвинута в 1967 г. B. MacKinney, изучавшим ее эпидемиологию у жителей Африки. В дальнейшем эту концепцию поддержали многие другие ученые, предполагавшие причастность к этому заболеванию вирусов группы Herpes: ВЭБ, ЦМВ в ассоциации с вирусом простого герпеса 1-го и 2-го иммунотипа, также вируса Т-клеточной лимфомы человека (HTLV).
Новый этап в понимании роли вирусов в развитии KS наступил в 1994 г., когда Y. Chang и соавторы обнаружили в ПЦР с использованием синтезированного ими праймера KS 330233 присутствие уникальной ДНК-последовательности в геноме опухолевых клеток, выделенных из биоптата очагов поражений кожи больного со СПИД-ассоциированным типом KS.
С учетом высокой частоты обнаружения HHV-8 в клетках очагов поражений KS, данных эпидемиологических исследований (обнаружение HHV-8 в очагах поражений больных различными типами KS как из эндемичных, так и неэндемичных регионов), а также подтверждения трансформирующего потенциала некоторых его генов, этот вирус в настоящее время рассматривается как наиболее вероятный кандидат на роль этиологического фактора данного заболевания. Это подтверждается и биологическими свойствами HHV-8: было установлено, что он кодирует белки, контролирующие рост и пролиферацию клеток, и обладает генетическим сродством по отношению к представителям подсемейства радиновирусов, обладающих трансформирующими свойствами. Этиологическая роль HHV-8 в развитии KS также была подтверждена в России. Причем сывороточные антитела к этому вирусу у здоровых доноров из России обнаруживались в 9,6% случаев.
Данные подтверждают возможность персистенции вируса в группах здоровых лиц и его активации в условиях иммуносупресии.
Высокая частота выявления HHV-8 в эякуляте здоровых доноров жителей Италии, которая также является эндемичным по KS регионом, не исключает возможности полового пути передачи данной инфекции. В связи с этим представляют интерес данные S. Lin и соавторов (1995), показавших, что у 13 из 30 ВИЧ-позитивных пациентов с наличием в эякуляте HHV-8 в течение 5 лет развилась KS, тогда как в эякуляте 30 ВИЧ-негативных пациентов без HHV-8 в те же сроки наблюдения KS не развилась ни в одном случае. Проведенные исследования отечественных авторов и полученные ими данные свидетельствуют о том, что ткани урогенитального тракта в некоторых случаях могут быть местом латенции HHV-8. При этом высокая частота хронических воспалительных поражений мочеполовых органов в группе больных c KS должна рассматриваться в качестве фактора, нарушающего гематотестикулярный барьер и тем самым способствующего проникновению в эякулят клеток воспаления, включая инфицированные HHV-8 В-лимфоциты. Необходимо учитывать роль хронического воспаления в снижении общего иммунитета и местного иммунного контроля в тканях репродуктивной системы.Такое воспаление может приводить к активации персистирующего там HHV-8. Установлено, что до 10% вирусов HHV-8, выявляемых в очагах поражения KS, находятся в литической фазе, в связи с чем этот вирус должен с высокой частотой обнаруживаться в лимфоцитах периферической крови. Однако HHV-8 в лимфоцитах периферической крови выявляется, как правило, только у больных с выраженной иммуносупрессией (СПИД-ассоциированным и иммуносупрессивным типом заболевания), тогда как у пациентов с другими типами KS инфицированные клетки содержатся в очагах поражения в эякуляте, а из крови, по-видимому, достаточно эффективно элиминируются. HHV-8 обнаруживали в эякуляте только при наличии у больных с KS хронического воспалительного процесса мочеполовых органов (хронический уретропростатит). Таким образом, эякулят у больных с KS является естественным резервуаром инфекции HHV-8. Инфицированные вирусом HHV-8 лимфоциты проникают в эякулят и сохраняются в нем в условиях аккумуляции CD8+ Т-лимфоцитов, ингибирующих иммунный ответ не только на сперматозоиды, но и на эти инфицированные клетки.
Вирус широко распространен в популяции: более 25% взрослого населения и 90% ВИЧ-инфицированных имеют антитела к литическим белкам HHV-8. HHV-8, как и ВЭБ или HVS, инфицирует в первую очередь лимфоциты и ассоциирован с клеточной трансформацией и иммортализацией. HHV-8 является возможным этиологическим агентом всех форм KS, связан с развитием некоторых В-клеточных лимфом, ангиоиммунобластоидной лимфаденопатии, болезни Кастлемана и ряда других лимфопролиферативных заболеваний.
Несмотря на большой арсенал антигерпетических препаратов терапия заболеваний, вызванных данными вирусами, представляет значительные трудности. Это обусловлено генотипическими особенностями возбудителя, длительной персистенцией вируса в организме, различной чувствительностью к препаратам. Исследования антивирусного действия некоторых препаратов показали, что HHV-6, 7, 8 малочувствительны к аналогам нуклеозидов. С определенным успехом в лечении были использованы ганцикловир и фоскарнет. Однако препаратов, которые были бы достаточно эффективны в лечении инфекции, вызванной HHV-6, 7, 8, пока не найдено.
Литература
- Исаков В. А., Борисова В. В., Исаков Д. В. Герпес: патогенез и лабораторная диагностика: Руководство для врачей. СПб.: Лань, 1999.
- Исаков В. А. Современные методы лечения герпетической инфекции// TERRA MEDICA NOVA. СПб., 1997. № 3. С. 2-7.
- Бехало В. А., Ловенецкий А. Н. Клиника, лечение и лабораторная диагностика герпесвирусных заболеваний человека: Руководство для врачей. М.: Ниармедик плюс, 1998.
- Ершов Ф. И., Оспельникова Т. П. Современный арсенал антигерпетических лекарственных средств//Инфекции и антимикробная терапия. М.: Медиа Медика, 2001. Т. 3. № 4. С. 100-104.
- Панченко Л. А., Кириченко И. И., Ходак Л. А. Возбудители герпесвирусных инфекций и наиболее важные клинические проявления у человека//Провизор. 1999.
- Мурзич А. В., Голубев М. А. Герпетическая инфекция//Южно-Российский медицинский журнал. 1998. № 3.
- Хахалин Л. Н., Соловьева Е. В. Герпесвирусные заболевания человека//Клиническая фармакология и терапия. 1998. Т. 7.
- Корнеев А. В., Арцимович Н. Г. Синдром хронической усталости и иммунной дисфункции//Лечащий Врач. 1998. № 3.
- Малашенкова И. К., Дидковский Н. А. Синдром хронической усталости//РМЖ. 1997. Т. 5. № 12.
- Львов Н. Д., Мельниченко А. В. Вирусы герпеса человека 6, 7 и 8-го типов — новые патогены семейства Herpesviridae//Вопросы вирусологии. 1999. Т. 44. № 3.
- Коломиец А. Г., Коломиец Н. Д. Новые герпесвирусы человека и вызываемая ими патология//Клиническая медицина. 1997. № 1.
- Перминова Н. Г., Тимофеев И. В., Палецкая Т. Ф., Максютов А. З., Кожина Е. М. Вирус герпеса 6-го типа (HHV-6): современное состояние вопроса// Вестник РАМН. 1998. № 4. С. 21-24.
- Молочков А. В., Кадырова Е. Л., Карташова М. Г., Будорагин Е. С., Гурцевич В. Э., Молочков В. А. К обнаружению вируса герпеса человека 8-го типа в тканях урогенитального тракта при идиопатической саркоме Капоши//Росс. журн. кожн. и венер. болезней. 2001. № 6. С. 7-10.
- Баринский И. Ф., Шубладзе А. К., Каспаров А. А., Гребенюк В. Н. Герпес: этиология, диагностика, лечение. М.: Медицина, 1986.
Е. Г. Белова, кандидат медицинских наук, доцент Т. К. Кускова, кандидат медицинских наук МГМСУ, Москва
Симптомы
Как правило, симптоматика проявляется только у маленьких детей или у взрослых с патологией иммунной системы, ВИЧ-инфицированных, принимающих медикаменты подавляющие иммунитет. Может возникнуть после перенесенных серьезных заболеваний, трансплантации и иных хирургических вмешательства. Симптоматика достаточно обширна, но чаще выражается в лихорадке и сыпи на коже и слизистых.
Цитомегаловирусная инфекция
- При приобретенной форме наблюдается:
- Повышение температуры.
- Общее недомогание, слабость.
- Головные боли.
- Увеличение лимфоузлов шеи, боль в горле.
Редко возникают осложнения в виде пневмонии, артритов, отмечаются симптомы гепатита.
Врожденная выражается в следующих симптомах:
- Гепатоспленомегалия ― увеличение селезёнки и печени.
- Микроцефалия ― значительное уменьшение размера черепа и, соответственно, головного мозга.
- Желтуха кожных покровов и склер.
- Петехии ― геморрагическая сыпь, возникающая из-за повреждения внутрикожных капилляров.
- Неврологические аномалии.
Заражение цитомегаловирусом во время беременности может привести к гибели эмбриона и к патологическим поражения плода. Сред них геморрагический синдром, поражения нервной системы. Чаще наблюдается нейросенсорная тугоухость и расстройство равновесия, реже ― интеллектуальные расстройства, эпилепсия, ДЦП, нарушение зрения, микроцефалия.
Вирус Эпштейна – Барр
Для первичного инфицирования характерны:
- Катаральная ангина.
- Заложенность носа.
- Увеличение лимфоузлов.
- Умеренное увеличение лимфоцитов.
Манифестная форма ― инфекционный мононуклеоз сопровождается:
- лихорадкой;
- общим недомоганием;
- головной болью;
- ангиной;
- увеличением шейных лимфоузлов, болезненностью;
- спленомегалей;
- гепатомегалией;
- желтухой.
Инфекционный мононуклеоз:
- Высокая температура.
- Головная боль.
- Воспаление зева и миндалин.
- Увеличение и болезненность лимфоузлов.
- Увеличение печени и селезенки.
При тяжелой форме заболевания могут возникнуть осложнения в виде отита, синусита, гепатита, паратонзиллярного абсцесса, пневмонии.
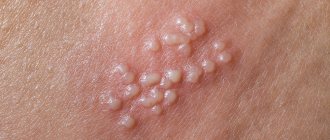
Вирус герпеса ВГЧ-6
Обладает широкой симптоматикой, наиболее часто отмечают следующие признаки:
- температура до +40 °С;
- симптомы интоксикации;
- эритематозная или папулезная сыпь;
- неяркая гиперемия зева.
Если у человека сильная иммунная система, без патологий, то ГЧ-6 протекает бессимптомно.
Вирус герпеса ВГЧ-7
Симптомы не выявлены. У лиц с иммунодефицитом может вызвать псевдокраснуху, лихорадку, розовый лишай, судороги, синдром хронической усталости.
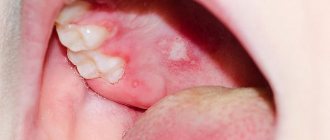
Вирус герпеса ВГЧ-8 (HHV-8, саркома Капоши)
Клинические проявления наблюдаются только при иммунодепрессии. Они выражены в появлении сосудистых уплотнений, образуются на коже и во рту. Это множественные геморрагические новообразования злокачественного характера. Со временем вирус может дать осложнение на легкие, желчный пузырь, желчевыводящие пути и иные внутренние органы.
Лечение
Поскольку вирус герпеса встраивается в геном клетки человека, удалить его невозможно. Терапевтические мероприятия направлены на заболевания, вызываемые герпесвирусами. Для лечения назначают этиотропных препараты и средства для снятия симптоматики. Выбор медикаментов, дозировка и метод лечения выбирают индивидуально, исходят из состояния больного, наличия осложнений и сопутствующих заболеваний.
Вирусы герпеса активизируются на фоне подавленного иммунитета, большинство пациентов ВИЧ-инфицированные. При этом лечение показано при иммунологически благоприятном состоянии, в этом случае риск осложнений меньше, шансы на излечение выше. Тем не менее, больные с плохим прогнозом тоже проходят индивидуальное, не всегда систематическое лечение.
Диагностика
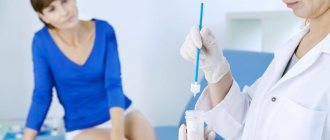
Диагностирование инфекций, вызванных герпесвирусами основывается на лабораторных анализах. Используют методы полимеразной цепной реакции, выполняемые в режиме реального времени.
ПЦР ― это самый точный способ обнаружения всех видов герпеса. Он также один из самых быстрых в производстве, позволяет выявить возбудителя на ранней стадии заболевания. Для получения результат достаточно небольшого количества искомого материала.
Особенностью ПРЦ-метода заключена в копировании специфичного для возбудителя участка ДНК. Он воспроизводится такое количества раз, которое увеличивает образец до приемлемого для диагностики размера.
В качестве образца подойдет любой биологический материал:
- венозная кровь;
- семенная жидкость;
- выделения из влагалища;
- слюна;
- ликвор;
- биоптат и иное.
Среди других методов диагностики герпеса молекулярно-биологические исследования биоптатов кожи для диагностики Саркомы Капоши. Исследуют волосяные фолликулы для подтверждения или исключения ВГЧ-6. Метод цифровой капельной ПЦР помогает выявить хромосомно-интегрированные и наследуемые формы вируса 6 типа. При тканево-инвазивной ЦМВ отдают предпочтение гистологическим и иммуногистохимическим исследованиям.
Когда назначают анализ на герпесвирусы
- При наличии симптоматики, указывающей на заболевания, вызываемые вирусами герпеса.
- Для дифференцирования герпесвирусных и других инфекций.
- При планировании беременности и при наличии патологии беременности.
- При комплексном обследовании ВИЧ-пациентов и людей с иммунодефицитом.
- Перед проведением иммуносупрессивной терапии.
- Для контроля за эффективностью терапевтических мероприятий.
Необходимо пройти анализ на герпес пациентам с гемобластозами, лимфопролиферативными болезнями. Показано исследование перед трансплантацией и после ее проведения.
Осложнения цитомегаловирусной инфекции
При ЦМВИ осложнения в большинстве случаев имеют специфический характер:
- плеврит и пневмония;
- миокардит;
- артрит;
- нарушение чувствительности;
- энцефалит.
Также наблюдаются неспецифические осложнения, которые обусловлены присоединением вторичной бактериальной инфекции. Речь идет о гнойных осложнениях. При этом температура тела повышается до 40-41 градуса, и появляется соответствующая клиническая картина поражения внутренних органов.
Цитомегаловирус может быть причиной выкидыша, мертворождения или смерти младенца сразу после рождения. Позаботьтесь о здоровье своего ребенка. Запишитесь на прием к врачу, чтобы своевременно выявить наличие болезни в организме и пролечить ее.
Эпидемиология [ править ]
Более 95% взрослых инфицированы и имеют иммунитет к HHV-7 [35], и более трех четвертей из них были инфицированы в возрасте до шести лет. [36] Первичная инфекция HHV-7 у детей обычно происходит в возрасте от 2 до 5 лет, что означает, что она возникает после первичной инфекции HHV-6. [37] Проведенный в 2014 году Медицинской школой Вашингтонского университета анализ 102 здоровых взрослых людей, отобранных в пяти основных средах обитания, показал, что HHV-7 присутствует у 98% из них, особенно во рту. [38] Исследование, проведенное в 2022 году на вироме крови человека у 8240 человек в возрасте от 2 месяцев до 102 лет, показало, что 20,37% из них были положительными на HHV-7. [39]
Патогенез (что происходит?) во время Цитомегаловирусной инфекции
Входными воротами для Cytomegalovirus является слизистая оболочка, преимущественно верхних дыхательных путей и ротоглотки. Инфицирование также может произойти через мочеполовую систему, желудочно-кишечный тракт и другие органы.
В месте внедрения не наблюдается структурных изменений. После того, как вирус проникает в организм, он начинает атаковать моно- и лимфоциты, а также эпителий слюнных желез, почек, легких и других внутренних органов. При этом наблюдается цитомегалия (увеличение пораженных клеток в размерах в 3-4 раза). В ядрах клеток происходит формирование незрелых вирионов. В результате клеточные структуры приобретают вид «совиного глаза». Активное течение болезни приводит к развитию депрессии большей части звеньев иммунитета, в т. ч. белка ИНФ-α.
В ответ на проникновение ЦМВ наблюдается развитие защитной реакции – образуются специфические антитела, и наблюдается гиперчувствительность замедленного типа. Данный процесс сопровождается появлением узелковых образований лимфоцитарных инфильтратов. Клетки, которые были инфицированы, продолжают функционировать, выделяя специальный секрет, обеспечивающий маскировку вируса от защитных функций организма человека.