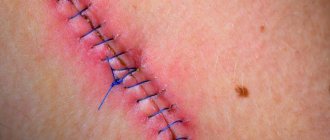
Любая колотая, рубленная, рванная и резанная рана может осложниться процессом нагноения. Даже если вы порезали ножом палец на кухне, не стоит думать, что это пустяк, потому что недостаточно обработанная рана может загноиться. Первые симптомы нагноения ран следует знать каждому по той причине, что эту проблему в большинстве случаев приходиться решать исключительно хирургическим путем.
Особенно эта проблема актуальна для тех, кто перенес какую-либо операцию, и после реабилитации выписался домой. Если дома не осуществляется уход за послеоперационными швами так, как предписал врач, то, при попадании инфекции, может начаться нагноение. Вопреки общепринятому мнению пациентов, нагноения после операций начинаются не из-за условий во время операции, а именно по вине пациентов, которые безответственно подходят к назначениям врача, оказавшись в домашних условиях.
Во время операции принципиально соблюдение абсолютной стерильности, и этот принцип никогда не нарушается. Врачи медицинского рекомендуют всегда полностью выполнять назначения, которые они делают, чтобы избежать подобных серьезных осложнений.
Как развивается процесс нагноения раны
Обычно нагноение начинается при инфицировании чистой раны, развивается отек вокруг раны, некроз тканей и появляются гнойные выделения. Если вокруг раны началось покраснение, которое сопровождается дергающей болью, усиливающейся по ночам, то это значит, что вы имеете дело с первым симптомом нагноения раны, и требуется принять срочные меры.
При осмотре раны видны омертвевшие ткани, выделение гноя. Ситуация опасна тем, что продукты распада всасываются организмом, и это приводит к нарастающей интоксикации организма. В результате появляются следующие симптомы:
- значительное повышение температуры;
- озноб;
- головная боль;
- слабость;
- тошнота.
Проблема раневой инфекции в последние годы стала чрезвычайно актуальной. Резко возросло число инфекционных осложнений со стороны операционных ран с исходом в тяжелый сепсис, вызванный грамотрицательными микроорганизмами, а также микроорганизмами, устойчивыми практически ко всем современным антимикробным препаратам.
Среди всех хирургических больных раневая инфекция встречается у 35-45%. Число послеоперационных гнойно-септических инфекций в 1998 г. увеличилось до 39% [14].
Одновременно с увеличением бактериальных инфекций возрастает частота грибов кандидаc и аспергилл, обусловленных чаще всего широким, нерациональным использованием антибактериальных, кортикостероидных, цитостатических препаратов, а также отсутствием концепции одновременного назначения с антибиотиками противогрибковых препаратов с профилактической целью. Не утрачивает свою актуальность проблема внутригоспитального распространения как аэробной, так и анаэробной (клостридиальной и неклостридиальной) инфекции.
Причины увеличения частоты и тяжести гнойной инфекции в хирургии многообразны и включают в себя следующие факторы:
— увеличение объема оперативных вмешательств, особенно у больных высокого риска;
— широкое использование методов инструментального обследования и лечения, сопровождающихся инфицированием больного (внутрисосудистые и мочевые катетеры, интубационные и трахеостомические трубки, эндоскопические манипуляции и др.);
— традиционные многолетние схемы назначения определенных групп антибиотиков с лечебной и профилактической целью без регулярного контроля динамики резистентности госпитальных штаммов к этим препаратам.
В зависимости от внедрившихся возбудителей и возникающих в ране изменений различают неспецифические (гнойная, анаэробная, гнилостная) и специфические (дифтерия раны, раневая скарлатина) раневые инфекции. Кроме того, через рану в организм проникает ряд инфекционных болезней, не носящих характера раневой инфекции, т.е. не сопровождающихся заметными нарушениями раневого процесса. Некоторые из этих общих инфекционных болезней обязательно связаны с инвазией возбудителя в рану (столбняк, бешенство, болезнь крысиного укуса), при других рана является лишь одним из возможных путей проникновения микробов (сифилис, сибирская язва). На практике целесообразно ориентироваться на распределение больных с раневой инфекцией по группам с учетом этиологических и клинико-патологических особенностей:
— острые гнойные заболевания кожи и мягких тканей (абсцедирующий фурункул, карбункул, гидраденит, мастит и др.);
— гнойные посттравматические раны мягких тканей (с повреждением или без повреждения костей, с синдромом длительного раздавливания мягких тканей);
— послеоперационные гнойные раны мягких тканей;
— хронические гнойные заболевания мягких тканей (трофические язвы различного происхождения, пролежни и пр.);
— гематогенный, послеоперационный или посттравматический остеомиелит;
— хирургический сепсис.
Независимо от происхождения раневого процесса, видового состава микрофлоры ран основными методами лечения являются хирургическое и активное комплексное воздействие на гнойный процесс, направленное на устранение дефекта тканей, подавление роста вегетирующей в ране микрофлоры или предупреждение нагноения.
Наряду со своевременно выполненным хирургическим вмешательством на гнойном очаге исход заболевания во многом предопределяется адекватной системной и местной антибактериальной терапией, строго ориентированной на данные бактериологических исследований.
Обоснованно можно считать только такое местное медикаментозное лечение, которое проводится строго в соответствии с патогенезом раневого процесса, т.е. с учетом фазы его течения [15].
Этиология раневых инфекций
За последние годы под влиянием различных факторов, в первую очередь мощного селективного действия антибиотиков, произошли значительные изменения этиологии раневых инфекций. В настоящее время ведущими возбудителями являются:
— стафилококки (S. aureus, S. epidermidis);
— £, B, Y-гемолитические и негемолитические стрептококки;
— представители семейства Enterobacteriaceae (E. coli, Citrobacters
spp.,
Klebsiella
spp.,
Enterobacter
spp.,
Serratia
spp.,
Proteus
spp.,
Providencia
spp.);
— неферментирующие грамотрицательные бактерии (Pseudomonas
spp.,
Acinetobacter
spp.,
Moraxella
spp.,
Flavobacterium, Achromobacter).
Отчетливо прослеживается зависимость видового состава ран от их происхождения. Так, например, если в группе с острыми гнойными заболеваниями стафилококк в монокультуре выявляется в 69,5% случаев, то у больных с посттравматическими гнойными ранами, хроническими гнойными заболеваниями кожи и мягких тканей, а также у больных с гнойными ранами и развившимся сепсисом выявляются сразу несколько патогенных микроорганизмов в 31,5, 48,8, 55,6% случаев соответственно. Остальную часть составляют представители семейства Enterobacteriaceae
в монокультуре.
В последние годы значительно чаще из ран стали выделяться грибы (9,9%), что, по-видимому, связано с недостаточным вниманием к этой проблеме, отсутствием надежной профилактики грибковой инвазии (табл.1).
Существенную роль в этиологии раневой инфекции играют также облигатные неспорообразующие анаэробные микроорганизмы, среди которых чаще всего встречаются Bacteroides
spp.,
Fusobacterium, Peptococcus
spp.,
Peptostreptococcus
spp.,
F. nucleatum,P. melaninogenicus.
Удельный вес чистой неклостридиальной и смешанной аэробно-анаэробной микрофлоры также зависит от локализации и происхождения гнойной раны.
В настоящее время имеется возможность значительно сократить длительность системной антибактериальной терапии за счет активного внедрения в практику лечения ран под повязками с современными препаратами, ориентированными не только на фазу раневого процесса, но и на видовой состав микроорганизмов ран.
Такая тактика при своевременном адекватном хирургическом вмешательстве и лечении правильно подобранными препаратами для местной терапии позволяет локализовать гнойный процесс, избежать генерализации инфекционного процесса.
Использование современных препаратов для местного лечения ран на всех этапах комплексного лечения позволяет сократить сроки системной антимикробной терапии, избежать развития побочных явлений, значительно уменьшить расходы на дорогостоящие антибактериальные препараты, избежать формирования резистентности микрофлоры к используемым системным антибиотикам.
В настоящее время разработано несколько групп препаратов для местного лечения ран в I и II фазах раневого процесса (табл. 2).
Основными группами препаратов являются антисептики, мази на полиэтиленгликолевой (ПЭГ) основе, современные биологически активные перевязочные средства, ферментные препараты, новые антисептики.
Антисептики
При выборе антисептиков, используемых как с профилактической, так и с лечебной целью предпочтение отдается препаратам с универсальным, широким спектром действия, активным против смешанной микрофлоры, обладающим микробоцидным или микробостатическим действием.
Йодофоры
В практике лечения ран достаточно широко используются новые комплексные соединения йода с поливинилпирролидоном (повидон-йод, бетадин, йодопирон, йодовидон и др.), обладающие микробоцидным и микробостатическим действием.
Препараты этой группы подавляют:
— грамположительные бактерии, включая энтерококки и микобактерии;
— грамотрицательные бактерии, в том числе псевдомонады, ацинетобактерии, клебсиеллы, протей;
— споры бактерий, грибы, вирусы, включая вирусы гепатита В и С, энтеро- и аденовирусы, а также анаэробные, спорообразующие и аспорогенные бактерии.
Все возбудители раневой инфекции не обладают к йодофорам ни естественной, ни приобретенной резистентностью.
На активность комплекса с поливинил-пирролидоном не влияет присутствие крови, гнойного отделяемого или некротических тканей [4].
Наибольшее распространение в практике лечения гнойно-воспалительных процессов получили две лекарственные формы комплексных соединений йода с поливинилпирролидоном — раствор и мазь.
Мази (1% йодопироновая мазь, мазь повидон-йод) применяются для лечения гнойных ран при обильной эксcудации. Растворы (йодопирон, повидон-йод) применяются как антисептики с профилактической целью для обработки операционного поля, кожи при выполнении пункций, закрытия операционных швов, а также с целью лечения ран, трофических язв, пролежней, при синдроме диабетической стопы в условии отсутствия большого количества раневого отделяемого.
Диоксидин
Диоксидин — один из двух препаратов, производных ди-N-окиси хиноксилина, разработанных в результате фундаментальных поисковых исследований в период с 1960 по 1980 г. во Всесоюзном научно-исследовательском химико-фармацевтическом институте (в настоящее время Центр по химии лекарственных средств — ЦХЛС ВНИХФИ, Москва).
За рубежом был разработан ряд препаратов этого класса веществ с высокой антимикробной активностью и широким антимикробным спектром (квиндоксин, меквидокс, карбадокс, темадокс, олахиндокс).
Препарат предназначен для лечения больных с раневой инфекцией, вызванной полирезистентной флорой, синегнойной палочкой и возбудителями неклостридиальной анаэробной инфекции. Этот препарат наиболее активен в отношении анаэробных бактерий (Clostridium
spp.,
Bacteroides
spp.,
P. melaninogenicus, Peptococcus
spp.,
Peptostreptococcus
spp., а также аэробных грамотрицательных бактерий —
Ps. aeruginosa, E. coli, Proteus
spp.,
Klebsiella
spp.,
Serratia
spp.) [1-3].
Следует отметить, что штаммы синегнойной палочки, так же как и грамположительные бактерии (стафилококки, стрептококки), более устойчивы к препарату. Именно поэтому, если позволяет клиническая ситуация, для местного лечения используется 1% раствор диоксидина без разведения.
В 70-90-е годы раствор диоксидина в монотерапии и комбинации с другими антибактериальными препаратами рассматривался как препарат выбора для лечения больных с сепсисом, разлитым и местным перитонитом, для профилактики и лечения гнойно-воспалительных процессов в печени и желчных путях, легких, желудке, аллотрансплантации почки, протезировании сосудов сердца и аортокоронарном шунтировании, в условиях искусственного кровообращения [11-13].
В настоящее время в клиниках России более 25 лет для лечения различных форм гнойной инфекции применяются различные лекарственные формы диоксидина:
а) для местного лечения
— 5% мазь, мазь «Диоксиколь» с содержанием 1% диоксидина, аэрозоль диоксидина («Диоксизоль»), полимерные композиции с диоксидином («Диовин», «Диотевин», Анилодиотевин», «Колладиасоб», «Дигиспон А», шовный материал;
б) для введения в полости, для ультразвуковых ингаляций
— 1% водный раствор в ампулах;
в) для введения внутривенно
— 0,5% водный раствор в ампулах.
Внутривенное введение диоксидина проводят по жизненным показаниям. Обосновывая и определяя показания к введению диоксидина внутривенно с позиций «польза — риск», следует учитывать, что за последние 15-20 лет созданы высокоэффективные антибактериальные средства, имеющие преимущества по сравнению с диоксидином по токсикологическим свойствам. Поэтому диоксидин назначают внутривенно только при неэффективности или непереносимости других химиотерапевтических средств, строго соблюдая рекомендуемые для препарата дозы и длительность каждой инфузии.
Диоксидин хорошо совместим с другими антимикробными препаратами. Клинические возможности диоксидина расширяются за счет его способности проникать через гематоэнцефалический барьер, что дает возможность его применения при лечении больных с менингитом, абсцессами мозга и гнойными черепно-мозговыми ранами.
Мирамистин
Отечественный антисептик мирамистин относится к четвертичным аммониевым соединениям (катионные поверхностно-активные вещества-ПАВ). Доклинические и клинические исследования показали, что мирамистин обладает выраженным антимикробным действием в отношении грамположительных и грамотрицательных, аэробных и анаэробных, спорообразующих и аспорогенных бактерий в виде монокультур и микробных ассоциаций, включая антибиотикоустойчивые госпитальные штаммы. Наиболее эффективен препарат в отношении госпитальных штаммов стафилококка и стрептококка. Препарат губительно действует на грибы, вирусы, простейшие.
В клиническую практику мирамистин был внедрен с начала 90-х годов прошлого столетия. В настоящее время препарат широко используется в комплексном лечении гнойных ран и сопутствующих воспалительных осложнений в бронхолегочной системе в виде ультразвуковых ингаляций и мочеполовой системе в виде инстилляций мочевого пузыря [5].
Лавасепт
Антисептический препарат, основным действующим веществом которого является полигексанид, рассматриваемый экспертами как препарат выбора для лечения контаминированных и инфицированных ран [16]. Полигексанид относится к группе положительно заряженных (катионные) полимеров, содержит ПАВ, благодаря которым снижается поверхностное натяжение, что обеспечивает более легкое удаление микробных биопленок.
Лавасепт обладает бактерицидным эффектом широкого спектра действия, активен в отношении грамположительных и грамотрицательных бактерий (в том числе Pseudomonas aeruginosa
), грибов, а также MRSA.
Пронтосан
Особую опасность для больного представляет «дремлющая» инфекция, агрессивность которой обусловливается изменчивостью микрофлоры, реактивностью организма, утратой активности традиционных системных антибиотиков и препаратов для местного медикаментозного лечения ран. Эта угроза сохраняется в особой степени при наличии у больного инородных тел, имплантируемых устройств, у больных с длительно не заживающими ранами, трофическими язвами, синдромом диабетической стопы, с посттравматическим и послеоперационным остеомиелитом, хроническими посттравматическими и послеоперационными ранами.
Установлено, что микроорганизмы и грибы при длительном пребывании в ране благодаря секретированными ими полимерам образуют тонкий слой — биопленку. Биопленка, образованная бактериями, грибами, представляет надежную защиту патогенов от ультрафиолетового излучения, антибиотиков, фагоцитоза и других факторов иммунной системы организма. Микробы в составе биопленки выдерживают концентрации антибиотиков в 100-1000 раз более, чем подавляющие планктонные клетки. Терапевтическое воздействие на биопленки может быть направлено на механизмы первоначальной адгезии бактерий к поверхности, блокирование синтеза или разрушение полимерного матрикса.
В настоящее время внимание исследователей этой проблемы привлечено к возможности использовать различные медикаментозные средства, разрушающие биопленку, образованную бактериями и грибами. Одним из таких препаратов является пронтосан, в состав которого входит полигексанид — полимеризованное производное бигуанида, действующий как местный катионный антисептик. Противомикробное действие полигексанида обусловлено неспецифическим сродством к клеточным мембранам микроорганизма, которое содержит большое количество кислых фосфолипидов. Полигексанид действует на бактериальные клеточные мембраны и повышает их проницаемость.
В практику внедрены две лекарственные формы пронтосана — 0,1%, 0,2% раствор и гель, в состав которого входят 0,1% полигексанид, 0,1% ундециленовый амидопропил — бетаин (ПАВ), глицерол (увлажнитель), гидроксиэтицеллюлоза (гелевый агент), вода.
Сорбенты и мази на основе ПЭГ
Следует помнить, что при обильной гнойной экссудации использование растворов антисептиков для местного лечения ран в виде марлевых тампонов считается порочным методом, так как тампоны, помещаемые в рану, быстро высыхают, не имеют длительной осмотической активности, необходимой для удаления гноя. В крайнем случае рана может заполняться комбинированным тампоном — в центр марлевого тампона помещается силиконовая трубка, через которую 3-6 раз в сутки шприцем в рану вводится антисептик по 10-20 мл.
Для лечения поверхностных инфицированных, гнойных и гнойно-некротических ран различной этиологии в фазе воспаления с успехом применяются биологически активные дренирующие сорбенты (аниловин, диовин, анилодиовин, диотевин, анилодиотевин, колласорб, колладиасорб), основным компонентом которых является гелевин. В качестве антимикробного препарата используется диоксидин. Протеолитическое действие сорбентов обусловлено введением в их состав протеолитических ферментов (террилитин, коллагеназа из гидробионтов). Обезболивающий эффект достигается благодаря наличию в составе местного анестетика — анилокаина [11].
Направленное применение биологически активных перевязочных средств с дифференцированным действием на раневой процесс с учетом его фазы и особенностей течения, предусматривающий проведение в I фазе раневого процесса сорбционно-аппликационной терапии с помощью биологически активных сорбентов или гелевых повязок с антимикробным, обезболивающим и протеолитическим действием с последующим лечением ран во II и III фазах раневого процесса биологически активными стимулирующими покрытиями со специфическим воздействием на процессы регенерации и эпителизации.
В последние годы появилась возможность более успешно лечить раны, используя новый комбинированный препарат Банеоцин, содержащий два высокоактивных бактерицидных компонента — бацитрацин (полипептидный антибиотик, ингибирующий синтез клеточной оболочки бактерий) и неомицин (аминогликозид, ингибирующий синтез белков), между которыми существует синергизм. Результаты многочисленных исследований свидетельствуют о высокой активности банеоцина в отношении грамотрицательной, грамположительной флоры, аэробов и анаэробов. Компоненты препарата проявляют синергизм в отношении высокорезистентных госпитальных штаммов Ps. аeruginosa, E. coli, S. aureus.
Для Банеоцина характерна способность создавать высокие бактерицидные концентрации в гнойном очаге и не оказывать системного влияния. В многочисленных исследованиях показано, что при лечении ран под повязками с Банеоцином в короткий срок достигается полная иррадикация патогенных возбудителей и надежная профилактика реинфицирования раневой поверхности госпитальными микроорганизмами без традиционной в таких случаях системной антимикробной терапии, назначаемой как с лечебной, так и с профилактической целью.
Препарат Банеоцин выпускается в двух лекарственных формах, ориентированных на фазы раневого процесса. Так, например, для лечения гнойных ран в I фазе раневого процесса используется порошок Банеоцина, который в течение 5 ч активно впитывает раневое отделяемое.
Для лечения ран во II фазе раневого процесса используется мазь Банеоцин, проявляющая локальное бактерицидное действие, необходимое для предупреждения реинфицирования госпитальными штаммами гранулирующих ран. Образующаяся при этом тонкая пленка препарата защищает тонкий слой молодого эпителия от повреждающих факторов.
Положительные свойства двух лекарственных форм Банеоцина — порошка и мази — с успехом реализуются как на амбулаторно-поликлиническом, так и стационарном этапе комплексного лечения больных разных групп:
— с очаговыми инфекциями кожи (гнойный гидраденит, паронихия, фурункул, карбункул);
— с ожогами, обморожениями;
— с трофическими язвами;
— для профилактики нагноения бытовых, спортивных и производственных ран, ссадин (нарушений целостности кожных покровов);
— для профилактики развития инфекционного процесса в области донорских ран при выполнении забора кожных трансплантатов в травматологии, хирургии, косметологии.
Безболезненность и атравматичность нанесения, глубокое проникновение в ткани, хорошая переносимость Банеоцина позволяют с успехом лечить больных с трофическими язвами даже в случаях отягощенного аллергологического анамнеза (непереносимость традиционных местных препаратов) или выявления высокорезистентных штаммов Ps. аeruginosa
[6].
Для лечения обширных и глубоких ран с гнойным процессом в первой фазе
на протяжении последних 25-30 лет с успехом применяются мази на основе ПЭГ (левосин, левомеколь, 5% диоксидиновая мазь, диоксиколь, 1% йодопироновая мазь, 1% мазь повидон-йод, 0,5% мирамистиновая мазь, йодметриксилен, нитацид, стрептонитол, 10% мазь мафенида ацетата, стрептолавен, сталланин-ПЭГ 3%, офломелид, и др.). Перечисленные препараты обладают различной осмотической активностью для дифференцированного лечения ран в I фазе раневого процесса с обильным или умеренным количеством раневого отделяемого (фурункулы, карбункулы, гидрадениты, маститы, абсцессы, флегмоны, нагноившиеся липомы, атеромы, гнойные послеоперационные и посттравматические гнойные раны, венозные трофические язвы, «диабетическая стопа» с локальным гнойно-некротическим процессом и др.
Указанные препараты обладают достаточно широким спектром активности в отношении как аэробных, так и неспорообразующих анаэробных микроорганизмов.
Несмотря на многолетнее интенсивное применение мазей, содержащих левомицетин или диоксидин, сохраняется их высокая антимикробная активность в отношении основных возбудителей хирургической инфекции.
При наличии в ране грамотрицательных бактерий, в частности синегнойной палочки, рекомендуется применять 10% мазь мафенида ацетата, 5% диоксидиновую мазь, мазь диоксиколь, мазь нитацид.
Для лечения неспорогенной анаэробной инфекции в сочетании с аэробной целесообразно использовать следующие препараты:
— с нитазолом (мази Стрептонитол и Нитацид);
— пенообразующий аэрозоль Нитазол;
— 5% диоксидиновую мазь, мазь диоксиколь.
При использовании мазей на основе ПЭГ побочные эффекты (клинически значимые) наблюдаются в 0,7% случаев, клинически незначимые — в 2,3% случаев. Чаще всего они проявляются в виде местных симптомов лекарственных дерматитов. В случаях непереносимости левомицетина, диоксидина лечение можно проводить мазью офломелид или 5% мирамистиновой мазью, обладающей не только широким спектром антимикробной активности, но и противовирусным, противогрибковым действием, что бывает чрезвычайно важно при лечении больных с трофическими и длительно не заживающими ранами.
Из новых мазей заслуживает особого внимания отечественный препарат стрептолавен, в состав которого входит энзим микробного происхождения (стрептолизин), антимикробный препарат мирамистин и сбалансированная по осмотическому действию основа, не вызывающая пересушивания тканей ран. Эта единственная в стране мазь с некролитическим действием в настоящее время успешно применяется при лечении больных с синдромом диабетической стопы, обширными ожогами, трофическими язвами, пролежнями [9].
Значительно расширились возможности успешного лечения больных с гнойными ранами, трофическими язвами, пролежнями, инфицированными ожогами с появлением новой мази Стелланин-ПЭГ 3%, содержащей 1,3-диэтилбензимидазолия трийодид, поливинилпирролидония низкомолекулярный, димексид, полиэтиленоксид 400 и 1500. Бактерицидный эффект препарата обусловлен входящим в его состав активного йода [9].
Как видно из табл. 3,
мазь стелланин-ПЭГ 3% по антимикробной активности не уступает известным препаратам (левомеколь, 5% диоксидиновая мазь).
Стелланин-ПЭГ обладает высокой антимикробной активностью в отношении как грамположительных, так и грамотрицательных микроорганизмов, в том числе метициллин-резистентных стафилококков (MRSA), E. faecalis, E. faecium,
а также
E. coli
и
Klebsiella
spp., продуцирующих бета-лактамазы расширенного спектра, а также способен подавлять жизнедеятельность и грибов
(C. albicans).
При лечении ран, трофических язв с выраженным болевым синдромом высокий клинический эффект достигается при использовании новой мази офломелид на основе ПЭГ, в состав которой в качестве обезболивающего компонента введен лидокаин, антимикробного компонента — офлоксацин.
Особая острота течения раневого процесса возникает при развитии у больного поливалентной аллергии. Выходом в таких клинических ситуациях является использование препаратов, содержащих серебро (мазь Аргосульфан — при необильном раневом отделяемом) или повязок Actisorb Plus (нетканное нейлоновое волокно с активированным углем и ионами серебра).
Для лечения ран с умеренным количеством раневого отделяемого и замедленным процессом регенерации (длительно не заживающие раны, трофические язвы, синдром диабетической стопы, пролежни и др.) показано применение оригинального отечественного препарата 15% Димефосфона, обладающего мембраностабилизирующей, антиацидотической, антимикробной, противовоспалительной активностью [10].
Лечение ран во II фазе раневого процесса
Для лечения умеренно или мало экссудирующих гнойных ран в стадии перехода во II фазу раневого процесса, а также при лечении донорских ран во время свободной кожной пластики аутодермотрансплантатом показано применение биологически активных гелевых повязок Апполо ПАК и Апполо ПАА, в состав которых включены йодовидон или мирамистин, а также местный анестетик анилокаин. Основу гидрогеля составляют сополимер акриламида и акриловой кислоты.
При выявлении признаков регенераторного процесса на фоне отсутствия обильного гноетечения и остающихся нерезко выраженных симптомах воспаления возможно лечение ран под повязками с использованием содержащих йод растворов: 10% Йодопирон, 1% Йодовидон, 1% повидон-йод, Сульйодопирон.
После купирования клиники острого гнойного процесса, исчезновения симптомов интоксикации, подтвержденного как клиническими, так и лабораторными тестами, возможна отмена общей антибактериальной терапии. В этих случаях местное лечение ран на этапе подготовки к окончательному закрытию швами или методом пластики проводятся под повязками с препаратами:
— биологически активные стимулирующие раневые покрытия с антимикробным и местно-анестезирующим действием (Дигиспон-А, Альгикол-ФА, Коллахит-ФА, Анишиспон);
— коллагенсодержащие раневые покрытия (Гентацикол);
— раневые покрытия на основе альгинатов (Альгипор, Альгимаф);
— раневое покрытие с серебром на основе коллагена и регенерированной целлюлозы (Промогран- Prisma);
— пенообразующие аэрозоли (диоксизоль, гентазоль, нитазол);
— мази с незначительной осмотической активностью (Метилдиоксилин, Аргосульфан, Фузимет, Стрептонитол, Биопин 5%, 10%; Банеоцин);
— масла (Милиацил, масло облепихи, масло шиповника).
Появление в стационарах новой мази Фузимет (комбинация фузидина натрия с метилурацилом) позволяет успешно лечить больных с выявленными в ранах метициллинрезистентных S. aureus
(MRSA), без включения в комплексную терапию ванкомицина или линезолида [7, 8].
Профилактика и лечение грибковых инфекций при системной и местной антимикробной терапии раневой инфекции
Чрезмерное увлечение различными антибактериальными препаратами при лечении инфекционных процессов без обязательной одновременно назначаемой противогрибковой терапии привело к тому, что проблема глубоких микозов в последние годы становится чрезвычайно актуальной, трудно решаемой. Так, например, смертность при кандидозной пневмонии составляет 65-70%.
На долю диссеминированного кандидоза приходится до 10-15% от всех внутрибольничных кровяных инфекций. При диссеминированном кандидозе возможно поражение грибами кожи с формированием подкожных абсцессов, целлюлита или отдельных групп мышц (кандидозный миозит). Чрезвычайно трудно поддается лечению поражение грибами почек и легких, нервной системы, сердца, позвоночника, реберных и грудино-ключичных хрящей, желудка, кишечника и желчевыводящих путей.
Кандидемия может быть непосредственной причиной смерти в 75% случаев, а кандидозный сепсис как причина смерти может достигать 88%.
К колонизации грибковой инфекции предрасполагают сахарный диабет, лечение антибиотиками, наличие постоянных катетеров, тяжелая нейтропения. Диссеминированный кандидоз возможен в результате заражения при хирургических операциях, инвазивных диагностических манипуляциях (пункции, биопсии, эндоскопии), гемодиализе и перитонеальном диализе. До 40,2% медицинского персонала могут быть носителями грибов рода Candida
spp., при этом 31,3% из них в ассоциации с
S. aureus,
43,7% с коагулазонегативными стафилококками, а 25% в монокультуре. Распространенность орофарингеального носительства грибов рода
Candida
spp. среди медицинского персонала отделения общей хирургии составляет 61,5%.
По данным исследования, выполненного в Институте хирургии им. А.В. Вишневского, частота выделения Candida albicans
из различных биологических сред, катетеров выявлялась в 8,6-12% случаев. Наиболее опасным источником распространения грибов был раствор фурацилина, из которого грибы выявлялись в 58,8% случаев.
Традиционно для предупреждения грибковой инфекции наряду с антибактериальными препаратами в подобных случаях назначаются кетоконазол или (при генерализации инфекции) флуконазол, флуцитозин или амфотерицин В. При генерализации грибковой инфекции длительность этиотропной терапии, как правило, составляет от нескольких недель до года.
Своевременный отказ от длительной системной антибактериальной терапии, отказ от традиционных антисептиков (раствор фурацилина), традиционных абсолютно неэффективных мазей на жировой основе и активное использование таких препаратов, как 1% раствор повидон-йода, растворы пронтосана, лавасепта (0,1%, 0,2%) или 0,5% мазь мирамистина, позволяет не только избежать серьезных осложнений течения раневого процесса, но и успешно бороться с грибковой инвазией, не прибегая к системной противогрибковой терапии.
Таким образом, в настоящее время фармацевтическая индустрия располагает возможностью выпускать в достаточно полном ассортименте современные, высокоэффективные препараты для успешного местного медикаментозного лечения ран, трофических язв, пролежней различной локализации и происхождения. Своевременное активное внедрение этих препаратов в повседневную практику практического здравоохранения позволяет значительно сократить расходы на приобретение системных дорогостоящих зарубежных препаратов (отечественных препаратов не существует).
Однако хотелось бы обратить внимание ведущих фармацевтических производств на недопустимое прекращение выпуска таких препаратов, как 5% диоксидиновая мазь, диоксиколь, нитацид, стрептонитол, 1% йодопироновая мазь, 0,5% мазь хинифурила, пенообразующих аэрозолей (диоксизоля, гентазоля, нитазоля, отечественных гидроколлоидов галаграна и галактона, коллагенового покрытия с гентамицином гентацикола, раневых покрытий, содержащих альгинат натрия (альгипор, альгимаф).
Сложившаяся ситуация требует активной позиции всех специалистов, занимающихся проблемой лечения хирургической инфекции. Чрезвычайно важен пересмотр стандартов лечения ран с использованием современных препаратов, так как с позиции доказательной медицины такие стандарты позволяют снизить летальность у больных сепсисом в среднем до 26,5%, что имеет чрезвычайную социальную значимость.
Своевременное оснащение бригад скорой медицинской помощи, бригад, оказывающих помощь пострадавшим в природных, техногенных катастрофах, военных конфликтах, врачей амбулаторного поликлинического звена, травматологических пунктов и стационаров, специализированных отделений гнойной хирургии современными препаратами для местного лечения ран, несомненно, будет способствовать уменьшению развития тяжелых гнойных осложнений и заболеваний, позволит в 2-3 раза сократить расходы на антибактериальные препараты.
Причины нагноения ран
Любая рана, маленькая или большая, считается инфицированной, потому что в нее в любом случае попадают бактерии. Однако, это далеко не всегда приводит к нагноению. Для того, чтобы развился этот деструктивный процесс тканей, требуются дополнительные условия:
- достаточное повреждение тканей;
- наличие в полости раны нежизнеспособных тканей;
- наличие в полости раны инородных тел;
- наличие в полости раны излившейся крови;
- высокая концентрация патогенных микроорганизмов.
Поэтому первые симптомы нагноения раны могут появиться даже после обычной занозы при условии, что ее частичка останется в ткани тела, и при этом на самом инородном теле будут патогенные микроорганизмы. К последним относятся те, которые ответственны за развитие гнойного процесса: стафилококки, стрептококки, кишечная палочка и подобные им микроорганизмы.
Помимо этого велик риск нагноения в том случае, когда у пациента в анамнезе сахарный диабет, сосудистые и соматические заболевания, лишний вес и пожилой возраст.
Характер раны также имеет значение для развития этого процесса. Так, колотая рана может загноиться по причине слишком узкого раневого канала из-за чего нет нормального оттока. В том случае, когда рана сопровождается размозжением окружающих тканей, нагноение происходит по причине слишком большого количества мертвых тканей в ране и обильного загрязнения. При этом быстрее и лучше заживают раны на голове и шее, а хуже всего – на стопах ног.
Виды послеоперационных рубцов
Келоидный.
Бугристый рубец из разросшейся соединительной ткани красного или синюшного цвета. На вид напоминает опухоль или шляпку гриба. Размер келоидного рубца больше самой раны, он болит, чешется, иногда пульсирует.
Гипертрофический.
Внешне похож на келоидный, но его размеры не выходят за пределы раны. Гипертрофический рубец не доставляет неприятных ощущений, со временем светлеет.
Нормотрофический.
Хорошо заживающий рубец – вначале выпуклый и покрасневший, спустя 3 месяца становится почти незаметным, чувствительность отсутствует.
Диагностика
Определение наличия самого свища не представляет затруднения. Для оценки его глубины и диаметра возможно применение специального зонда, вводимого в образовавшийся ороантральный ход. Для оценки распространенности воспаления и наличия дополнительных ходов возможно использование рентгенографии верхней челюсти с введением контрастного вещества.
Оценка наличия инородного тела или верхушки корня зуба проводится во время рентгенографии или непосредственно в процессе операции по закрытию свища. В случае отсутствия эффекта от антибактериальной терапии, возможно проведение посева микрофлоры для определения ее резистентности к антибиотикам различного типа действия.
Почему возникают послеоперационные боли
Послеоперационная боль по МКБ-10 (Международной классификации болезней) относится к неуточненным видам боли и не несет никакой сигнальной информации ни для пациента, ни для врача, так как понятны причины и механизмы ее возникновения. Поэтому современные принципы ведения больных после операций предусматривают максимальное избавление их от неприятных болевых ощущений. Тем более, что боль оказывает негативное влияние не только на заживление, но и на жизненно важные процессы в организме: работу сердечно-сосудистой, дыхательной, пищеварительной, центральной нервной системы, а также на свертывание крови4.
Формирование болезненных ощущений обеспечивается многоуровневой реакцией, которая связывает непосредственную зону повреждения (раневую поверхность) и центральную нервную систему. Начинается она с механических стимулов в области разреза и выделения биологически активных веществ (простагландинов, брадикининов и других)4, а заканчивается обработкой информации в коре головного мозга и подключением эмоционального и психологического компонентов.
Болевой синдром развивается в результате возникновения зон повышенной болевой чувствительности (гипералгезий). Первичная гипералгезия связана непосредственно с повреждением и формируется вблизи раны. Область вторичной гипералгезии захватывает более обширный участок и возникает позже, в течение следующих 12-18 часов4, так как связана со стимуляцией других видов рецепторов. Именно она и отвечает за сохранение и усиление болевых ощущений на вторые-третьи сутки после операции, а в последующем, за развитие хронического болевого синдрома7.
Наверх к содержанию
Симптомы появления
Процесс формирования свища сложно отследить, он может занимать от нескольких дней, как случается при остром панкреатите, так и несколько месяцев, как при постлучевых изменениях тканей.
Проявления на начальном этапе формирования свища обусловлены его первопричиной, как правило, местным воспалительным процессом с исходом в гнойное расплавление тканей с болью и инфильтрацией, часто интоксикацией и лихорадкой.
Вне обострения воспалительной реакции свищевой ход прощупывается как тяж. Размеры уплотнения вокруг свищевого хода обусловлены воспалительной инфильтрацией и разветвлением самих свищевых ходов, рубцовыми изменениями окружающих тканей, ранее вовлекавшимися в воспалительный конгломерат.
Сформированный свищ имеет вход и, иногда, выход, ткани вокруг него уплотнены, из отверстия можно выдавить отделяемое: гной, желчь, панкреатический сок и так далее. При свищевом ходе из кишки во влагалище из половых органов может вытекать кал, при соустье кишки с мочевым пузырём из ануса подтекает моча. Отделяемое из кишечного свища имеет каловый запах, гнойный секрет из влагалища тоже специфически пахнет. Особенно тяжёлым окружающим кажется запах отделяемого свища, ведущего из зоны распада злокачественной опухоли.
Воспаление вызывает болевой синдром от небольшого дискомфорта до невыносимых болей. Опухолевые свищи не болят, поскольку формируются внутри распадающегося новообразования.
При активизации инфекции с формированием затеков гнойного содержимого присоединяется общая реакция: интоксикация, высокая температура, потливость и бледность, сердцебиение и учащённое дыхание.
Лечение
Чтобы определить возбудителя и назначить правильное лечение, необходимо исследовать раневое отделяемое и выявить чувствительность бактерий к разным группам антибиотиков. Обычный инфильтрат устраняется путем зондирования раны с удалением гнойной жидкости. Чтобы снизить давление на ткани, может производиться снятие швов.
Пациенту назначается постельный режим. Лечение гнойного воспаления предусматривает обязательное удаление шовного материала, очистку раны и установку дренажа. Анаэробная инфекция требует иссечения пораженных тканей, а в некоторых случаях и дополнительного оперативного вмешательства.
При любой форме воспаления рану ежедневно дренируют и очищают от гноя. По мере заживления может производиться повторное наложение швов и нанесение марлевых повязок с ранозаживляющими мазями. В качестве профилактики нагноения швов необходимо строго соблюдать врачебные указания и следовать ряду антисептических мероприятий.
Гигиена больного
Правила гигиены помогут избежать присоединения вторичной инфекции, они заключаются:
- В использовании антисептиков, растворы применяют регулярно, до полного заживления повреждений. Антисептики купируют рост и размножение патогенных микроорганизмов.
- В подмывании. Рекомендуется проводить их минимум 2 раза в день, с использованием теплой воды. Можно отдать предпочтение отварам трав, используют: ромашку, кору дуба, подорожник.
- В смене постельного и нижнего белья, которую осуществляют ежедневно. Предпочтение отдается натуральным тканям.
Краткая анатомическая сводка
Верхняя челюсть содержит в себе гайморову пазуху (верхнечелюстной синус), альвеолярный отросток, расположенный под синусом и ряд иных анатомических образований. При отсутствии патологии, корни зубов верхней челюсти плотно зафиксированы в альвеолярном отростке. В норме между верхушками корней зубов и полостью пазухи находится от 3 до 15 мм костной ткани.
Свищ — патологический ход, образовавшийся вследствие инфекционно-воспалительного процесса. Ввиду того, что при проведении синус лифтинга количество костной ткани уменьшено, то при попадании инфекции в операционную рану происходит расплавление мягких и твердых тканей альвеолярного отростка и дна гайморовой пазухи. Формируется ороантральное соустье, свищ сообщающий полость синуса с ротовой полостью.
Профилактика осложнений
Если человеку не так давно была проведена операция, то исключить вероятность развития осложнений помогут следующие рекомендации:
- Не нарушайте диету, четко следуйте рекомендациям врача, проводите обработку раны, в случае возникновения проблем обращайтесь к врачу в экстренном порядке.
- Следите за показателями температуры, отслеживайте изменения, повышение указывает на течение в организме воспалительного процесса. Можно вести дневник, в который следует записывать показатели температуры тела. Измерять ее придется по 3 раза в стуки.
- Старайтесь избегать проблем со стулом и пищеварением, запоры и приступы диареи вряд ли помогут восстановиться быстрее.
- Соблюдайте питьевой режим, потребляйте в стуки достаточное количество жидкости. Это поможет нормализовать работу органов ЖКТ.
- Принимайте антибиотики курсом. В случае прекращения лечения, даже при значительном улучшении состояния, риск развития осложнений возрастает. Поскольку воспалительный процесс не был купирован полностью.
- Ведение активного образа жизни также считается профилактической мерой, но не стоит забывать о предписаниях врача. Если организм ослаблен, то дополнительные нагрузки не принесут пользы.
- Прием витаминов и иммуностимуляторов также стоит расценивать, как профилактику осложнений.
- Придется избегать систематических переохлаждений организма, стрессовых ситуаций, заболеваний воспалительного характера носоглотки.
- В период межсезонья повышать иммунитет, в случае возникновения устранять дисбаланс в кишечнике.
- После полного восстановления 2 раза в год проводить профилактику заболеваний паразитарного характера.
Пассивный образ жизни, вредные привычки, частые стрессы – все это ослабляет организм, снижает его защитные функции. По этой причине придется вести размеренный образ жизни, заниматься спортом, отказаться от алкоголя и курения.
Рекомендуем видео:
Лечить парапроктит после операции можно различными способами, но оптимальным считается комплексный подход. Так удается достичь лучших результатов. Грамотно составления терапии помогает избежать рецидива болезни и повторного проведения хирургического вмешательства. А еще она значительно снижает риск развития осложнений.
Диета после операции
Считается составляющим лечения, поскольку ускоряет восстановление, снижает риски развития осложнений. Она подразумевает отказ от определенных продуктов, что нормализует работу органов пищеварительной системы и снижает неприятную симптоматику, которая часто наблюдается у больных в постоперационный период.
В таблице указанные продукты, которые не запрещены, а также те, от употребления которых придется отказаться:
| Что запрещено: | Что разрешено: |
| бульоны из мяса; | овощные бульоны; |
| капуста в любом виде, за счет наличия в составе грубой клетчатки; | зеленый лук, шпинат, свекла (желательно в вареном виде), морковь (можно есть сырой), огурцы и редис; |
| чай, кофе, сладкие газированные напитки; | компоты из сухофруктов, морсы из ягод, овощные и фруктовые соки, не запрещается пить воду, в том числе и минеральную, только без газа; |
| не стоит употреблять в пищу рис, овсяные хлопья, круизную крупу, а также фасоль и горох; | можно есть гречневую, манную, ячневую и пшеничную кашу, приготовленную на воде; |
| сладкая выпечка, различные продукты, приготовленные из рафинированной муки: пряники, сушки, печенье; | не стоит исключать из рациона хлеб; |
| свинина и говядина; | в вареном виде можно есть мясо курицы, индейки или кролика – это диетические продукты; |
| жирных сортов рыба: сельдь, лосось. | нежирные сорта рыб, такие как хек, треска, камбала. |
Несмотря на то, что не запрещается пить фруктовые соки, от фруктов все же придется отказаться. Больным можно кушать только печеные яблоки.
При этом пища должна отвечать определенным характеристикам:
- Усваиваться легко и не нагружать желудок.
- Не провоцировать повышенное газообразование в органах ЖКТ, не вызвать проблем со стулом.
- Полностью перевариваться в кишечнике.
Жирная, соленая, кислая, пряная, копченая и острая еда – под запретом. Не стоит употреблять алкоголь и его производные. Придется отказаться от фаст-фуда, лапши быстрого приготовления и полуфабрикатов.
Профилактические меры до и после синус лифтинга для предотвращения развития свища
Свищ после синус лифтинга и костной пластики довольно легко предотвратить, принимая определенные группы препаратов до и после оперативного вмешательства, а также соблюдая правила гигиены ротовой полости.
Правила поведения после операции
Охранительный режим должен продолжаться от 5 до 7 дней после проведения синус лифтинга. Он включает в себя ряд особенностей поведения:
- При чистке зубов применяются специальные стоматологические пасты с антибактериальными и противовоспалительными свойствами: Солкосерил, Лакалут, Сенсодин. Гигиенические процедуры полости рта необходимо проводить дважды в день (утром и перед сном). Чистить зубы на прооперированной стороне необходимо с большой осторожностью, чтобы не нарушить состояние тканей и имплантата после операции.
- При приеме пищи жевательные движения должны осуществляться исключительно на здоровую сторону. Пить всевозможные жидкости через соломинку строго противопоказано. Также на неделю стоит отказаться от сладкой пищи.
- В течении первых двух недель необходимо прекратить занятия любыми видами спорта. Особенно это касается легкой атлетики, гимнастики, велоспорта, плаванья и единоборств. От последних стоит воздержаться на протяжении месяца.
- Старайтесь по возможности не чихать, не кашлять, избегать травм и ушибов головы, тряски.
- Во время сна не ложитесь на прооперированную сторону.